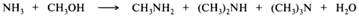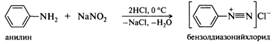Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Спектральные характеристики.Содержание книги
Поиск на нашем сайте
ИК-спектроскопия. Положение полос поглощения аминогрупп в спектре определяется условиями съемки спектров (в твердом виде, жидком состоянии, в растворах или газовой фазе) и зависит от того, является ли аминогруппа свободной (неассоциированной) или она участвует в образовании меж- и внутримолекулярных водородных связей. Полосы поглощения, обусловленные валентными колебаниями связей N—Н, проявляются в ИК-спектрах в области 3500-3200 см-1. Первичные амины имеют две полосы поглощения. Более высокочастотная обусловлена асимметричными валентными колебаниями N—Н, менее высокочастотная — симметричными. В спектрах аминов в разбавленных растворах в инертных растворителях эти две узкие полосы наблюдаются при 3500 и 3400 см-1. Вторичные амины имеют одну полосу поглощения, соответствующую валентным колебаниям N—Н. Для алифатических аминов в инертных растворителях она наблюдается в области 3350-3310 см-1, в спектрах смешанных аминов Аг—NH—Alk полоса поглощения N—Н расположена при более высоких частотах 3450 см-1. Если аминогруппа участвует в меж- или внутримолекулярной водородной связи (в твердом или жидком состоянии, в концентрированных растворах), то полосы поглощения валентных колебаний N—Н смещаются в низкочастотную сторону. Однако это смещение не столь значительно. Ассоциированные первичные амины дают полосы поглощения в областях 3420-3330 см-1 (vasNH2) и 3330-3250 см-1 (vsNH2), вторичные — в области 3300-3150 см-1. При неполной ассоциации можно наблюдать одновременно полосы свободной и ассоциированной аминогруппы, поэтому в области 3500-3200 см-1 может быть более двух полос, характерных для первичных аминов, и более одной полосы, характерной для вторичных. Деформационные колебания аминогруппы наблюдаются в области 1650-1500 и 950-650 см-1. Первичные амины имеют полосы поглощения плоских деформационных колебаний средней интенсивности 1650-1580 см-1, вторичные — слабой интенсивности в интервале 1600-1500 см-1. При образовании водородных связей частоты деформационных колебаний повышаются. Амины имеют также полосы поглощения валентных колебаний С—N. В алифатических аминах этим колебаниям соответствует поглощение в области 1250-1020 см-1 средней интенсивности, в ароматических аминах — интенсивное поглощение в интервале частот 1340-1260 см-1.
Взаимодействие аминов с кислотами вызывает сильные изменения в спектрах. В солях первичных аминов колебаниям N—Н соответствует широкая сильная полоса в области 3100-2600 см-1. Соли вторичных и третичных аминов имеют интенсивное поглощение в области 2700-2250 см-1. Соли аминов можно дополнительно идентифицировать по деформационным колебаниям. Соли первичных аминов поглощают в области 1600-1575 и 1550-1500 см-1, соли вторичных аминов — в диапазоне 1620-1560 см-1. Спектроскопия ПМР. Сигналы протонов группы NH алифатических и циклических аминов наблюдаются в интервале 0,5-3,0 м. д., ароматических аминов — при 3,0-5,0 м. д. Поскольку амины могут образовывать водородные связи, положение сигналов зависит от концентрации амина, природы растворителя и температуры. Протоны NH-группы могут обмениваться на дейтерии, и при добавлении к образцу тяжелой воды D2O эти сигналы исчезают. Аминогруппа, находящаяся в сопряжении с бензольным кольцом, повышает электронную плотность в орто- и пара-положениях кольца, что приводит к экранированию соответствующих протонов и смешению их сигналов в более сильное поле по сравнению с бензолом. В спектрах ПМР как аминов сигналы ароматических протонов представляют собой сложные мультиплеты. Электронная спектроскопия. Алифатические амины в УФ- и видимой области не поглощают. Сопряжение аминогрупп с бензольным кольцом приводит к значительному батохромному смещению полос поглощения бензола с увеличением их интенсивности. Полагают, что наряду с локальным π→π*-переходом бензольного кольца в данное поглощение вносит вклад переход с переносом заряда от донорной группы в кольцо (анилин. Анилин в ближней УФ-области имеет две полосы поглощения — 230 нм и 280 нм. 28. Амины: кислотно-основные свойства; нуклеофильные свойства – реакции алкилирования аминов и аммиака, четвертичные аммониевые соли, раскрытие a –оксидного цикла аминами с образованием аминоспиртов. Химические свойства. В молекулах алифатических аминов атом азота находится в состоянии sp3-гибридизации, поэтому они, подобно аммиаку, имеют пирамидальную конфигурацию. Например, углы связей С—N—С в триметиламине равны 108° и очень близки к величинам углов Н—N—Н в молекуле аммиака.
Теоретически вторичные и третичные амины с разными углеводородными радикалами могут существовать в виде энантиомеров, однако обычные алифатические и ароматические амины до сих пор не выделены в виде индивидуальных энантиомеров. Это объясняется тем, что молекулы аммиака и аминов постоянно претерпевают пирамидальную инверсию, которую следует рассматривать как быстрое обращение конфигурации. Инверсия осуществляется через тригональное переходное состояние (в центре схемы):
В молекулах ароматических аминов неподеленная пара электронов атома азота находится в сопряжении с π-электронами ароматического кольца, вследствие чего амплитуда, с которой совершается пирамидальная инверсия, значительно уменьшается.
Четвертичные аммониевые соли, имеющие четыре разных радикала, могут быть разделены на индивидуальные энантиомерные формы, т. е. эти формы обладают конфигурационной устойчивостью. Так, аллилбензилметилфениламмонийиодид выделен в виде индивидуальных энантиомеров, каждый из которых обладает оптической активностью:
Основные свойства. Амины, как и аммиак, проявляют основные свойства, что обусловлено наличием в их молекулах атома азота с неподеленной парой электронов. При взаимодействии с кислотами амины превращаются в аммониевые соли:
Соли аминов в отличие от других ониевых солей гидролитически устойчивы, хорошо растворимы в воде, легко кристаллизуются из водных растворов и, как правило, более устойчивы, чем свободные основания. Многие лекарственные вещества, относящиеся к классу аминов, применяются в виде солей с минеральными и реже органическими кислотами. Алифатические амины — сильные основания. Водные растворы аминов имеют щелочную среду по лакмусу:
Можно предположить, что третичные амины с тремя алкильными заместителями, обладающими +I-эффектом, будут более сильными основаниями, чем вторичные и первичные амины. Однако стерические факторы, определяющие доступность основного центра для атаки протоном, оказывают противоположное влияние. Чем больше у атома азота радикалов и чем они разветвленнее, тем сильнее экранирована неподеленная пара электронов атома азота и затруднено ее взаимодействие с протоном. Поэтому самыми сильными основаниями должны быть первичные и вторичные амины со сравнительно короткими и неразветвленными радикалами. Сольватация (взаимодействие молекулы растворенного вещества с молекулами растворителя) оказывает на основность влияние, сходное с влиянием стерических факторов, поскольку с увеличением числа и разветвленности углеводородных радикалов уменьшается способность катиона замещенного аммония (сопряженной кислоты) связывать молекулы растворителя. Многие экспериментальные данные не укладываются в изложенные выше сравнительно простые схемы. Таким образом, чисто умозрительные рассуждения не могут служить достоверной основой для предсказания сравнительной основности алифатических аминов. На практике можно руководствоваться тем, что значения рКВН+ большинства алифатических аминов укладываются в сравнительно узкий интервал: от 10,6 до 11,2. Такое небольшое различие в основности не обеспечивает существенного преимущества какому-нибудь из аминов в конкурентной реакции протонирования. Основность ароматических аминов существенно ниже, чем у аминов алифатического ряда. Это объясняется тем, что неподеленная пара электронов атома азота вступает в р,π-сопряжение с электронами бензольного кольца:
Заместители в кольце существенным образом влияют на основность: электроноднорные заместители ее увеличивают, а электроноакцепторные снижают. Если из-за стерических затруднений неподеленная пара электронов выводится из сопряжения, то основность амина значительно возрастает. Так, объемные алкильные радикалы N,N-диизопропиланилина не могут расположиться в одной плоскости с бензольным кольцом из-за взаимного отталкивания с атомами водорода в орто-положениях, поэтому его основность (pKBH+ 7,4) значительно выше, чем у анилина. Аналогичного рода стерические затруднения возникают у N,N-диалкиланилинов, имеющих одновременно заместители в положениях 2 и 6. В молекуле 1,8-бис(диметиламино)нафталина обе диметиламиногруппы также не могут расположиться в одной плоскости с ароматической системой, и это соединение обладает удивительно высокой основностью (рKвн+ 12,4), его протонированная форма устойчива за счет того, что протон прочно удерживается неподеленными парами электронов двух атомов азота.
Кислотные свойства. NH-Кислотные свойства аминов выражены в значительно меньшей степени, чем основные. Для алифатических и ароматических первичных и вторичных аминов рКA имеют значения 30—35. Таким образом, более слабыми кислотами, чем амины, являются разве что алканы. Амины проявляют кислотные свойства только в присутствии очень сильных оснований, таких, как, например, металлоорганические соединения, и превращаются при этом в амиды металлов (не путать с амидами карбоновых и сульфоновых кислот!):
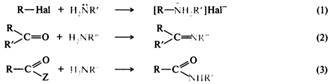
Амиды щелочных металлов являются очень сильными основаниями и используются в органическом синтезе. Нуклеофильные свойства. Нуклеофильные свойства аминов, как и основные, обусловлены наличием неподеленной пары электронов атома азота. Некоторые реакции, в которых амины участвуют в качестве нуклеофильных реагентов, будут далее и были ранее. Это — алкилирование аминов [(1)], взаимодействие с карбонильными соединениями [(2)] и ацилирование производными карбоновых кислот [(3)]:
Алкилирование. Амины, как и аммиак, подвергаются алкилированию галогеноалканами. Алкилирование аммиака приводит к образованию первичного амина, из первичных аминов образуются вторичные, из вторичных — третичные, из третичных — четвертичные аммониевые соли. Образующаяся в ходе реакции замещенная аммониевая соль обменивается протоном с аммиаком или амином, поэтому в реакции алкилирования получается смесь аминов с разным числом алкильных радикалов:
Реакцию алкилирования редко удается остановить на какой-то отдельной стадии ввиду того, что различия в нуклеофильности и основности первичных, вторичных и третичных аминов не настолько значительны, чтобы повлиять на различие в скоростях реакций алкилирования аминов разной степени замещения. В промышленности аммиак и низшие амины алкилируют низшими спиртами в газовой фазе при температуре 300—500 °С над оксидами алюминия, кремния, тория, хрома и др. При этом образуются смеси первичных, вторичных и третичных аминов. Этим способом получают в основном метил- и этиламины:
Реакции аминов с эпоксидами. При взаимодействии первичных и вторичных аминов с эпоксидами (оксиранами) происходит нуклеофильное раскрытие напряженного трехчленного α-оксидного цикла и образуются β-аминоспирты. В замещенных эпоксидах нуклеофильная атака происходит, как правило, на наименее замещенный атом углерода оксидного цикла (правило Красуского):
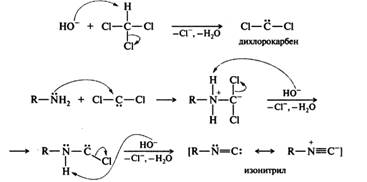
29. Амины: реакции первичных, вторичных и третичных алифатических и ароматических аминов с азотистой кислотой; карбиламинная реакция (изонитрильная проба). Нуклеофильные свойства. Карбиламинная (изонитрильная) реакция (качественная реакция). При взаимодействии первичных аминов с хлороформом в спиртовом растворе щелочи образуются изонитрилы (карбиламины):
Первоначально из хлороформа при действии щелочи в результате α-элиминирования образуется дихлорокарбен — электронодефицитная частица с секстетом электронов у атома углерода. Затем происходит нуклеофильное присоединение амина к дихлорокарбену, после в результате последовательного отщепления 2 молекул HCl образуется изонитрил:
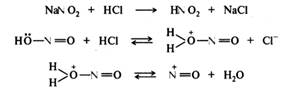
Изонитрилы представляют собой жидкости с отвратительным тошнотворным запахом, ядовиты. Они нестойки, разлагаются при действии кислот на исходный первичный амин и муравьиную кислоту. Карбиламинную реакцию применяют в аналитических целях для обнаружения первичных аминов. Реакции с азотистой кислотой. Амины разных типов с азотистой кислотой реагируют неодинаково. Некоторые продукты этих реакций, например соли диазония, имеют широкое практическое применение. Первичные ароматические амины. В результате реакции первичных ароматических аминов с азотистой кислотой при низких температурах в присутствии сильных минеральных кислот образуются соли арилдиазония, а сама реакция называется реакцией диазотирования:
Реакция диазотирования имеет сложный механизм. Показано, что она имеет третий порядок, а скорость ее зависит от концентрации свободного амина (основания), азотистой и сильной минеральной кислот. Нитрозирующей частицей (электрофилом) в этой реакции в зависимости от условий проведения могут быть протонированная форма азотистой кислоты H2O+NO; оксид азота(III) N2O3; нитрозилхлорид NOC1 или нитрозил-катион N=O+, образующиеся из нитрита натрия и минеральной кислоты:
В сильнокислой среде нитрозирующей частицей является нитрозил-катион, который взаимодействует со свободным амином, находящимся в равновесии с аммониевым ионом. Необходимо акцентировать, что электрофильной атаке подвергается именно свободный амин, а не его соль, несмотря на то что концентрация его в сильнокислой среде может быть очень низкой:
Образующийся катион (I) отщепляет протон и превращается в N-нитрозоамин (II), который перегруппировывается в диазогидроксид (III). Диазогидроксид протонируется и отщепляет воду, превращаясь в катион диазония (IV):
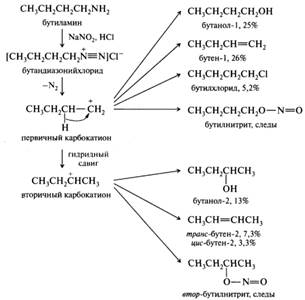
Условия диазотирования конкретного амина зависят от двух факторов — основности и растворимости в воде. Амины с относительно высокой основностью и хорошей растворимостью в воде диазотируют в разбавленных растворах в слабокислой среде. В этих условиях в растворе создается достаточно высокая концентрация свободного амина, а в качестве нитрозирующих агентов выступает свободная или протонированная азотистая кислота, а также оксид азота(III). Амины с низкой основностью, например нитроанилины, диазотируют в концентрированной серной кислоте, в этой среде образуется более сильный электрофил — нитрозил-катион. Ароматические соли диазония — неустойчивые соединения, в сухом виде взрывчаты, большинство из них хорошо растворимы в воде, поэтому их получают в водных растворах и сразу же используют для дальнейших превращений. Первичные алифатические амины. Эти амины при действии азотистой кислоты в водных растворах подвергаются дезаминированию. Вначале они, как и ароматические амины, образуют соли диазония, однако последние крайне неустойчивы и разлагаются даже в растворах и при низких температурах. Катион алкилдиазония отщепляет молекулу азота и превращается в соответствующий карбокатион. Образовавшийся карбокатион присоединяет различные нуклеофилы, имеющиеся в реакционной смеси (воду, хлорид- или нитрит-ион), отщепляет протон и превращается соответственно в спирт, алкилгалогенид, нитрозоэфир или этиленовый углеводород. Кроме того, карбокатионы могут претерпевать различные перегруппировки. Перегруппировочные карбокатионы в свою очередь также могут отщеплять протон и присоединять различные нуклеофилы. Таким образом, в результате дезаминирования первичных алифатических аминов образуется, как правило, сложная смесь продуктов, что иллюстрируется схемой дезаминирования бутиламина:
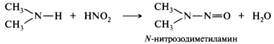
Вторичные амины. Алифатические и ароматические вторичные амины при взаимодействии с азотистой кислотой образуют N-нитрозоамины, представляющие собой нерастворимые в воде маслянистые жидкости или твердые вещества желтого цвета. Эту реакцию можно использовать для идентификации вторичных аминов:
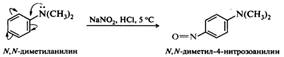
Третичные ароматические амины. Электрофильной атаке нитрозирующим агентом подвергается ароматическое кольцо, при этом образуются пара-нитрозопроизводные:
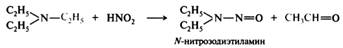
Третичные алифатические амины. При низких температурах и низкой концентрации азотистой кислоты третичные алифатические амины не реагируют. При нагревании происходит дезалкилирование третичного амина с образованием вторичного N-нитрозоамина и окислением отщепившегося радикала в соответствующий альдегид:
|
|||||||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 1746; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.171.121 (0.013 с.) |