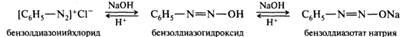Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Диазосоединения: номенклатура; реакция диазотирования (вопр. 29), механизм и условия проведения; строение солей диазония; влияние рН среды на устойчивость солей диазония.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Диазо- и азосоединения — родственные классы, которые характеризуются наличием азогруппы, представляющей собой группировку из двух атомов азота, соединенных двойной или тройной связью. В молекулах диазосоединений азогруппа соединена с одним углеводородным радикалом, в молекулах азосоединений — с двумя.
Несмотря на то что многие из этих соединений неустойчивы, они имеют большое практическое значение. Диазосоединения — высокореакционные вещества, благодаря чему нашли применение в органическом синтезе. Азосоединения широко используются в качестве красителей. Номенклатура. Используемый термин «родоначальная молекула» (не путать с родоначальной структурой!) подразумевает молекулы RH и R'H, производными которых будут азосоединения R—N=N—R'. Названия соединений, в которых азогруппа — N=N— связывает радикалы, производимые от идентичных родоначальных молекул без заместителей, образуются добавлением префикса азо- к названию незамещенной родоначальной молекулы. Заместители обозначаются с помощью префиксов и суффиксов обычным способом. Азогруппа получает наименьшие локанты. Один набор локантов отмечается штрихами:
В тех случаях, когда азогруппа связывает различные радикалы, в названии азосоединения частицу азо- помещают между полными наименованиями родоначальных молекул (замещенных). Если необходимы цифровые указатели для обозначения положения азогруппы, то их помещают между частицей азо- и названиями молекул, к которым эти локанты относятся. Первой указывается более сложная родоначальная молекула. Азогруппа получает наименьшие возможные локанты. Все заместители в первом компоненте обозначаются префиксами (за исключением тех, которые включаются в тривиальное или полутривиальное название этого компонента). Локанты в первом компоненте обозначаются цифрами без штрихов, а во втором — со штрихами:
Другой способ – в названии соединений RN=NR' радикал RN=N— рассматривают как заместитель в родоначальной молекуле R'H. В качестве R'H выбирают такую молекулу, которая имеет большее число старших характеристических групп. Если их число в обоих компонентах одинаково, то за R'H принимают более сложную молекулу, а группу RN=N— называют R-азо-. Суффикс должен получить наименьший возможный локант; следующие, насколько возможно, низкие номера должна иметь азогруппа:
Если радикалы R и R' образованы из одной и той же незамещенной родоначальной молекулы и несут одинаковое число характеристических групп, обозначаемых суффиксами, то названию незамещенного азосоединения предшествует префикс азоди-, а перед ним перечисляются префиксы других заместителей. Суффикс, а за ним азогруппа должны иметь по возможности меньшие локанты. Как и в первом способе, используются цифровые указатели со штрихами и без них:
Реакции аминов с азотистой кислотой. Первичные ароматические амины. В результате реакции первичных ароматических аминов с азотистой кислотой при низких температурах в присутствии сильных минеральных кислот образуются соли арилдиазония, а сама реакция называется реакцией диазотирования:
Реакция диазотирования имеет сложный механизм. Показано, что она имеет третий порядок, а скорость ее зависит от концентрации свободного амина (основания), азотистой и сильной минеральной кислот. Нитрозирующей частицей (электрофилом) в этой реакции в зависимости от условий проведения могут быть протонированная форма азотистой кислоты H2O+NO; оксид азота(III) N2O3; нитрозилхлорид NOC1 или нитрозил-катион N=O+, образующиеся из нитрита натрия и минеральной кислоты:
В сильнокислой среде нитрозирующей частицей является нитрозил-катион, который взаимодействует со свободным амином, находящимся в равновесии с аммониевым ионом. Необходимо акцентировать, что электрофильной атаке подвергается именно свободный амин, а не его соль, несмотря на то что концентрация его в сильнокислой среде может быть очень низкой:
Образующийся катион (I) отщепляет протон и превращается в N-нитрозоамин (II), который перегруппировывается в диазогидроксид (III). Диазогидроксид протонируется и отщепляет воду, превращаясь в катион диазония (IV):
Условия диазотирования конкретного амина зависят от двух факторов — основности и растворимости в воде. Амины с относительно высокой основностью и хорошей растворимостью в воде диазотируют в разбавленных растворах в слабокислой среде. В этих условиях в растворе создается достаточно высокая концентрация свободного амина, а в качестве нитрозирующих агентов выступает свободная или протонированная азотистая кислота, а также оксид азота(III). Амины с низкой основностью, например нитроанилины, диазотируют в концентрированной серной кислоте, в этой среде образуется более сильный электрофил — нитрозил-катион. Ароматические соли диазония — неустойчивые соединения, в сухом виде взрывчаты, большинство из них хорошо растворимы в воде, поэтому их получают в водных растворах и сразу же используют для дальнейших превращений. Ароматические диазосоединения. Более значимыми в практическом отношении являются диазосоединения ароматического ряда. Общая формула ароматических диазосоединений ArN2X, где X — анион сильной кислоты или ковалентносвязанная группа, например, гидроксильная. Строение диазосоединения существенно зависит от характера частицы X. В тех случаях, когда она представляет собой анион сильной кислоты (HSО4—, Сl—, СlO4—), диазосоединение существует в виде ионно построенной соли диазония. Атомы азота в катионе диазония линейно расположены в плоскости бензольного кольца. Расстояние между атомами азота приблизительно равно 0,109 нм, т. е. по характеру эта связь приближается к тройной. Положительный заряд в катионе распределен в основном на обоих атомах азота, но частично он компенсируется и за счет π-электронного облака ароматического кольца, и таким образом, можно представить следующие резонансные структуры катиона бензолдиазония:
Поскольку первые две структуры вносят наибольший вклад в резонансный гибрид, то катион арилдиазония часто записывается как ArN2+. Соли диазония устойчивы только при низких температурах (0—5 °С). В сухом виде взрываются даже при низких температурах, поэтому их растворы, как правило водные, готовят по мере надобности и долго не хранят. Комплексы солей диазония с некоторыми кислотами Льюиса — двойные диазониевые соли — сравнительно устойчивы и могут довольно долго сохраняться в сухом виде при комнатной температуре. К ним относятся соли с такими анионами, как BF4—, ZnCl3—, SbCl4—, SbCl6—, HgCl3—, FeCl4—, например:
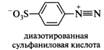
Соли диазония, получаемые из ариламиносульфоновых кислот, существуют в виде диполярных ионов; вероятно, поэтому многие из них малорастворимы в воде.
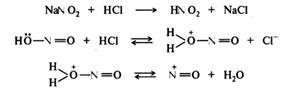
Строение диазосоединений зависит от pH среды: в кислой среде они существуют в виде солей диазония, при подщелачивании раствора соли диазония превращаются в ковалентно построенные диазогидроксиды. Диазогидроксиды обладают кислотными свойствами, поэтому при дальнейшем добавлении щелочи они отщепляют протон и образуют соли — диазотаты. При подкислении растворов диазотатов снова образуются диазогидроксиды и соли диазония:
|
||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 2128; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.009 с.) |