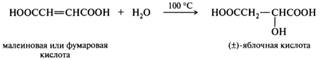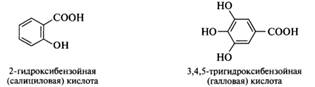Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Фталевая кислота, фталевый ангидрид, фталимид; синтез фенолфталеина, его индикаторные свойства.Содержание книги
Поиск на нашем сайте
Фталевая кислота ( бензол-1,2-дикарбоновая ) — С6Н4(СООН)2 —получается гидролизом фталевого ангидрида, который в свою очередь образуется при каталитическом окислении о-ксилола или нафталина кислородом воздуха. Кислота → Фталевая кислота при нагревании легко отщепляет воду и превращается во фталевый ангидрид. Именно фталевый ангидрид, а не сама кислота, служит источником для получения различных производных фталевой кислоты. Более половины производимого в мире фталевого ангидрида расходуется на получение средних (полных) эфиров фталевой кислоты — диметил-, диэтил- и диоктилфталатов. Эти эфиры добавляют в качестве пластификаторов к поливинилхлориду для придания эластичности изделиям из него. Диметилфталат используется как средство, отпугивающее комаров. Частным случаем ацилирования по Фриделю-Крафтсу является конденсация фенола с фталевым ангидридом. Реакция протекает при нагревании с кислотным катализатором (концентрированная серная кислота или хлорид цинка) и приводит к образованию фенолфталеина:
Фенолфталеин применяется в химии как кислотно-основный индикатор, в медицине — как слабительное средство (пурген). Использование фенолфталеина в качестве индикатора основано на его взаимодействии с разбавленными растворами щелочей (pH >8,5) с образованием окрашенного дианиона хиноидной структуры (III), процесс возникновения которого можно представить следующим образом:
Под действием щелочи в бесцветном фенолфталеине происходит размыкание (гидролиз) γ-лактонного кольца, и возникший бесцветный спирт (I) самопроизвольно отщепляет молекулу воды с образованием мононатриевой соли (II) желтого цвета. Дальнейшее взаимодействие со щелочью приводит к образованию динатриевой соли (III) и к углублению окраски до малиновой, что обусловлено удлинением цепи сопряжения (хиноидный фрагмент выделен цветом). В сильнощелочной среде (pH >10) наблюдается обесцвечивание раствора в результате перехода динатриевой соли (III) в тринатриевую соль (IV), в которой кольца не сопряжены между собой. Из дикарбоновых кислот или их ангидридов получают циклические имиды. Легче образуются имиды с пятичленным циклом:
Для синтеза о-аминобензойной (антраниловой) кислоты удобнее использовать фталевый ангидрид, из которого щелочным гидролизом в присутствии аммиака получают сначала фталаминовую кислоту. Расщепление последней по Гофману приводит к образованию антраниловой кислоты. Аналогичным расщеплением фталимида антраниловая кислота получается с выходом 84%:
51. Гидроксикислоты алифатического ряда: номенклатура, химические свойства как гетерофункциональных соединений; специфические реакции a –, β –, g – гидроксикислот; лактоны, лактиды, отношение к гидролизу; представители – молочная, винная, яблочная, лимонная. Вещества природного происхождения часто представляют собой гетерофункционалъные соединения, в молекулах которых имеются различные функциональные группы. В роли таких групп чаще выступают гидроксильная, карбонильная, карбоксильная, а также аминогруппа. Гетерофункциональные соединения, наряду с полифункциональными, играют важную роль в биологических процессах и часто представляют собой действующее начало лекарственных средств. Различные комбинации только двух функциональных групп приводят к гетерофункциональным классам. Разумеется, возможны и другие сочетания функциональных групп.
В первом приближении химические свойства гетерофункциональных соединений представляют собой сумму свойств, обусловленных каждой группой в отдельности. Однако во многих случаях наличие различных функциональных групп приводит к усилению или ослаблению свойств, присущих монофункциональным соединениям, и, что более важно, вызывает появление специфических химических свойств, присущих только гетерофункциональным соединениям. Гидроксикислотам и называются соединения, в молекулах которых содержатся гидроксильная и карбоксильная группы. Эти функциональные группы могут быть присоединены к алифатической цепи (алифатические гидроксикислоты) или к ароматическому кольцу, в последнем случае используют иногда родовое название фенолокислоты. По взаимному расположению функциональных групп различают α-, β-, γ-, δ-гидроксикислоты и т. д. Буквы греческого алфавита указывают положение гидроксильной группы относительно карбоксильной, причем отсчет ведется от ближайшего к карбоксильной группе атома углерода, т. е. от атома С-2. Следует обратить внимание на то, что в заместительной номенклатуре ИЮПАК для замещенных карбоновых кислот локанты α-, β-, γ- и т. д. не употребляются. Систематические названия гидроксикислот строятся по общим принципам заместительной номенклатуры. Однако для ряда широко распространенных представителей предпочтительными являются тривиальные названия (в скобках):
Химические свойства. Специфические свойства гидроксикислот обусловлены принадлежностью этих соединений одновременно к спиртам и карбоновым кислотам и во многом зависят от взаимного расположения функциональных групп. Образование лактонов. Лактонами называются внутренние сложные эфиры гидроксикислот, т. е. соединения, в которых сложноэфирная группировка —С(О)О— включена в циклическую структуру. При нагревании в кислой среде, а иногда просто при стоянии в растворе, γ- и δ-гидроксикислоты подвергаются внутримолекулярной этерификации с образованием пяти- и шестичленных лактонов, например:
Легкость лактонизации γ- и δ-гидроксикислот объясняется повышенной термодинамической устойчивостью пяти- и шестичленных циклических соединений. Циклы меньшего или большего размера в этих условиях не образуются. По номенклатуре ИЮПАК лактоны, образованные из алифатических кислот, называют, добавляя суффикс -олид к названию углеводорода с тем же числом атомов углерода. Цифрой указывают место замыкания цикла, начиная нумерацию от карбонильного атома углерода. Так, приведенный выше γ-бутиролактон имеет систематическое название 4-бутанолид. Допускаются (и даже чаще используются) общепринятые названия, происходящие от тривиальных названий соответствующих негидроксилированных кислот. В этом случае место замыкания цикла обозначается греческими буквами. Оба типа номенклатуры показаны в приведенных ниже примерах:
Хотя гидроксикислоты с более удаленной гидроксильной группой не образуют лактонов в рассмотренных выше условиях, при применении специальных мер их лактонизация становится возможной. Такие условия заключаются в удалении воды из сферы реакции для смещения равновесия вправо и в использовании очень низких концентраций субстрата для предотвращения протекания межмолекулярной этерификации. Этим путем был синтезирован макроциклический лактон растительного происхождения тибетолид. Лактонам присущи многие свойства сложных эфиров. Так, при нагревании со щелочами или кислотами, а иногда и просто в водном растворе, они гидролизуются в соответствующие гидроксикислоты. Аналогично сложным эфирам щелочной гидролиз лактонов необратим, тогда как в кислой среде ɛ- и особенно γ-гидроксикислоты находятся в равновесии с лактонами. Наибольшую устойчивость к гидролизу проявляют γ-лактоны. Образование лактидов. Лактидами называются циклические эфиры, построенные из двух и более остатков гидроксикислот (необязательно α-гидроксикислот). α-Гидроксикислоты не способны образовывать лактоны (трехчленные α-лактоны вообще не известны). Тем не менее при нагревании этих кислот в результате межмолекулярной этерификации образуется димерный продукт, легко превращающийся в более устойчивый шестичленный циклический диэфир — лактид:
Название лактидов включает корень тривиального латинского названия гидроксикислоты, суффикс -ид и умножающий префикс ди-, три- и т. д., указывающий число молекул, образующих лактид. Например, дигликолид — от гликолевой кислоты, дилактид, дисалицид и трисалицид — от салициловой кислоты (однако префикс ди- часто опускается):
По химическим свойствам лактиды подобны сложным эфирам. При кипячении с водой или щелочами они легко гидролизуются в гидроксикислоты. Гликолид и лактид при 150-220 °С в присутствии катализаторов превращаются в линейные полиэфиры — полигликолид и полилактид соответственно:
Оба полимера как сложные эфиры гидролизуются в щелочной и кислой средах и медленно — в водной среде. Последнее свойство позволяет использовать эти полимеры в медицине как рассасывающиеся материалы (хирургические нити, лекарственные капсулы, носители лекарств и др.). Реакции элиминирования. При нагревании или под действием минеральных кислот β-гидроксикислоты легко подвергаются дегидратации с образованием α,β-ненасыщенных кислот:
Внутри- или межмолекулярная этерификация в этом случае невозможна, так как привела бы к образованию неустойчивого четырех- или восьмичленного цикла (лактона и лактида соответственно). Направленность реакции определяется большей подвижностью атома водорода в α-положении по сравнению с γ-положением, хотя в некоторых случаях изомерные β,γ-ненасыщенные кислоты также образуются. Образование β-лактонов из β-гидроксикислот возможно только под действием сильных дегидратирующих агентов, таких, как карбодиимиды:
В щелочной среде β-гидроксикислоты претерпевают ретроальдольное расщепление, характерное для альдолей, что приводит к образованию альдегида (или кетона) и карбоновой кислоты:
Своеобразному элиминированию — отщеплению муравьиной кислоты — подвергаются α-гидроксикислоты при кипячении с разбавленными минеральными кислотами:
Нагревание α-гидроксикислот с концентрированной серной кислотой также приводит к образованию карбонильных соединений с одновременным элиминированием монооксида углерода и воды — продуктов разложения муравьиной кислоты. Представители. Молочная кислота — СН3СН(ОН)СООН — была впервые обнаружена в прокисшем молоке, отсюда и получила название. Многие квашеные продукты также содержат молочную кислоту, образующуюся в результате молочнокислого брожения сахаристых веществ. Благодаря наличию в молекуле асимметрического атома углерода молочная кислота может существовать в виде двух оптически активных энантиомеров — D- и L-форм — и оптически неактивной рацемической формы. Последняя представляет собой молочную кислоту брожения. L(+)-Молочная кислота, образуется в мышечной ткани как продукт расщепления и дальнейшего превращения полисахарида гликогена. D(-)-Молочная кислота может быть получена под действием микроорганизмов, например, Lactobacillus leishmanii или Escherichia coli. Соли и сложные эфиры молочной кислоты называются лактатами. Яблочная кислота — НООС-СН2СН(ОН)-СООН — представитель гидроксидикарбоновых кислот. Яблочная кислота, как и молочная, существует в виде двух энантиомеров и рацемата. Следует обратить внимание на то, что рацемат яблочной кислоты плавится при более высокой температуре, чем сами L- и D-формы, т. е. он представляет собой индивидуальное вещество, а не механическую смесь энантиомеров. L(-)-Яблочная кислота, содержится в незрелых яблоках, плодах рябины и барбариса. Примечательно, что удельное вращение яблочной кислоты в водных растворах сильно зависит от концентрации. Так, L-энантиомер в растворах с массовой долей ниже 34% левовращающий, а выше — правовращающим. Синтетическую (±)-яблочную кислоту получают либо гидролизом бромо- или хлороянтарной кислоты, либо гидратацией малеиновой или фумаровой кислоты, например. Аналогичная реакция протекает и в организме. При этом фумаровая кислота гидратируется с образованием L-яблочной кислоты.
На примере стереоизомеров яблочной кислоты показали возможность взаимопревращений энантиомеров:
Лимонная кислота — НООС-СН2С(ОН)(СООН)СН2-СООН — наиболее распространенная гидрокситрикарбоновая кислота. Она содержится в плодах цитрусовых, некоторых ягодах и фруктах, а также в листьях махорки, из которых ее получают в промышленном масштабе. Главный промышленный способ получения лимонной кислоты заключается в сбраживании сахаристых веществ под действием грибов. Будучи одновременно α- и β-гидроксикислотой, лимонная кислота при нагревании подвергается как дегидратации с образованием аконитовой кислоты, так и элиминированию муравьиной кислоты, приводящему к 3-оксоглутаровой (ацетондикарбоновой) кислоте:
Дегидратация лимонной кислоты происходит и в организме, что является одной из стадий цикла Кребса. Нагревание с серной кислотой приводит к расщеплению лимонной кислоты на ацетондикарбоновую и муравьиную кислоты, которые распадаются далее с выделением соответственно диоксида и монооксида углерода:
Лимонная кислота и ее соли (цитраты) широко используются в пищевой промышленности и фармации. Винные кислоты — НООС-СН(ОН)СН(ОН)-СООН — простейшие и важнейшие представители дигидроксидикарбоновых кислот. Их молекулы содержат два центра хиральности. D-Винная (виннокаменная) кислота была первым оптически активным веществом, для которого была установлена абсолютная конфигурация. Кроме того, среди химиков долгое время не было единого мнения по отнесению энантиомеров винных кислот к D- или L-ряду. Чаще все же отнесение делается на основании конфигурации верхнего в проекции Фишера центра хиральности. С использованием R,S-стереохимической номенклатуры все разночтения снимаются.
Все винные кислоты — кристаллические, растворимые в воде вещества с приятным кислым вкусом. Обращает на себя внимание большая разница в растворимости рацемической (рац-) винной кислоты, называемой виноградной кислотой, и любого из энантиомеров винной кислоты. Более высокая температура плавления рацемата говорит о том, что в кристаллическом виде он не является механической смесью D- и L-энантиомеров, а представляет собой индивидуальное вещество. Соли и эфиры винной кислоты называются тартратами, а кислые соли и эфиры — гидротартратами. D-Винная кислота содержится во многих растениях, но особенно много ее в виноградном соке. В процессе приготовления вина накапливается и выпадает в осадок так называемый «винный камень», представляющий собой кислую соль — гидротартрат калия. Эта соль является одной из немногих калиевых солей, плохо растворимых в воде. На низкой растворимости гидротартрата калия основано применение кислоты в аналитике для определения ионов калия. Двойная соль — тартрат калия-натрия, известная под названием сегнетова соль (или правильнее — сеньетова), подобно вицинальным диолам, способна образовывать с гидроксидом меди(II) растворимое в воде комплексное соединение ярко-синего цвета. Оно используется для качественного и количественного определения альдегидов (качественная реакция) и моносахаридов под названием реактива Фелинга. L-Винную кислоту получают расщеплением виноградной кислоты на энантиомеры. В очень небольшом количестве она также содержится в виноградных винах. Мезовинная кислота, не найденная в природе, может быть получена окислением малеиновой кислоты с помощью перманганата калия или тетраоксида осмия ОsО4 с образованием продукта цис-гидроксилирования:
Все винные кислоты при длительном нагревании в кислой, нейтральной и особенно легко в щелочной средах подвергаются частичному или полному обращению конфигурации центров хиральности. Так, из любой оптически активной винной кислоты при обращении конфигурации только одного центра образуется мезовинная кислота, а при обращении обоих центров происходит полная рацемизация до установления равновесия между тремя формами.
Фенолокислоты: номенклатура, химические свойства как гетерофункциональных соединений; представители фенолокислот и их эфиров-салициловая, n–аминосалициловая, кумаровая, галловая, метилсалицилат, фенилсалицилат, ацетилсалициловая кислота. Гидроксикислотам и называются соединения, в молекулах которых содержатся гидроксильная и карбоксильная группы. Эти группы присоединены к ароматическому кольцу, используют родовое название фенолокислоты. По взаимному расположению функциональных групп различают α-, β-, γ-, δ-гидроксикислоты и т. д. Буквы греческого алфавита указывают положение гидроксильной группы относительно карбоксильной, причем отсчет ведется от ближайшего к карбоксильной группе атома углерода, т. е. от атома С-2. Следует обратить внимание на то, что в заместительной номенклатуре ИЮПАК для замещенных карбоновых кислот локанты α-, β-, γ- и т. д. не употребляются. Систематические названия гидроксикислот строятся по общим принципам заместительной номенклатуры. Однако для ряда широко распространенных представителей предпочтительными являются тривиальные названия (в скобках):
Химические свойства. Специфические свойства гидроксикислот обусловлены принадлежностью этих соединений одновременно к спиртам и карбоновым кислотам и во многом зависят от взаимного расположения функциональных групп. Образование лактидов. Лактидами называются циклические эфиры, построенные из двух и более остатков гидроксикислот (необязательно α-гидроксикислот). α-Гидроксикислоты не способны образовывать лактоны (трехчленные α-лактоны вообще не известны). Тем не менее при нагревании этих кислот в результате межмолекулярной этерификации образуется димерный продукт, легко превращающийся в более устойчивый шестичленный циклический диэфир — лактид:
|
||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 3339; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.102.43 (0.008 с.) |

 Ангидрид→
Ангидрид→