Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ароматические амины: влияние аминогруппы на реакционную способность ароматического ядра; реакции галогенирования, сульфирования, нитрования. Защита аминогруппы.Содержание книги
Поиск на нашем сайте
Электрофильное замещение в ароматических аминах. В ароматических аминах неподеленная пара электронов атома азота аминогруппы вступает в p,π-сопряжение с ароматическим кольцом, вследствие чего аминогруппа является сильным электронодонором, облегчает электрофильную атаку ароматического кольца и направляет вновь вступающие заместители в орто- и пара-положения. Однако из-за повышенной склонности аминов к окислению, а также из-за проявления ими основных свойств реакции электрофильного замещения в ароматическом кольце аминов протекают с некоторыми особенностями. Одной из них является протонирование аминогруппы в кислой среде (амин превращается в ион аммония); при этом меняется ориентирующее действие функциональной группы — из электронодонора и орто- и пара-ориентанта она превращается в электроноакцептор и мета-ориентант:
Галогенирование. Галогенирование ароматических аминов осуществляется довольно легко. Например, бромирование анилина протекает в водном растворе при комнатной температуре и приводит к образованию трибромопроизводного. Аналогично протекает и хлорирование:
Для получения монозамещенного продукта анилин бромируют в менее полярном, чем вода, растворителе или бромируют анилин, предварительно защищенный ацильной группой. В результате образуется преимущественно пара-изомер. Защиту снимают кипячением п-бромоацетанилида с разбавленной хлороводородной кислотой, а образовавшийся п-бромоанилин отгоняют с водяным паром после подщелачивания реакционной среды.
Поскольку бензольное кольцо сильно активировано по отношению к электрофильной атаке, то возможно его прямое иодирование. Анилин иодируется в пара-положение, а выделяющийся иодоводород связывается добавленным в реакционную смесь гидрокарбонатом натрия:
Нитрование. Прямое нитрование ароматических аминов азотной кислотой или нитрующей смесью сопровождается их окислением и не применяется в синтезе нитропроизводных. Например, нитрование анилина смесью азотной и серной кислот приводит к получению 3- и 4-нитроанилинов в соотношении ~ 2: 1 и сложной смеси продуктов окисления. Нитрование в большом избытке серной кислоты или олеума позволяет ввести нитрогруппу в мета-положение, поскольку в этом случае нитруется аммониевый ион. Так, продуктом нитрования N,N-диметиланилина в избытке серной кислоты является N,N-диметил-3-нитроанилин:
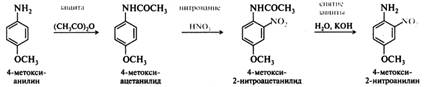
Для получения орто- и пара-производных нитрованию подвергают ацилированные, т. е. защищенные амины. Ацилированная аминогруппа, вследствие практически отсутствующей основности, не протонируется и полностью сохраняет орто- и пара-ориентирующее действие. Этим способом, например, был получен 4-метокси-2-нитроанилин с общим выходом ~75%. Вначале 4-метоксианилин (п-анизидин) ацилируют уксусным ангидридом, затем нитруют ацильное производное 70%-й азотной кислотой. Защиту снимают с помощью щелочного гидролиза.
При нитровании ацетанилида получается смесь о- и п-нитроацетанилидов, которые затем гидролизуются в соответствующие нитроанилины. Нитрование ацетанилида в среде серной кислоты приводит к преимущественному образованию пара-изомера, а в растворе уксусного ангидрида — орто-изомера. Подобное явление наблюдается при нитровании и других ацилированных аминов. Сульфирование. Анилин при длительном нагревании с эквивалентным количеством серной кислоты при 180-200°С превращается в сульфаниловую кислоту. Вначале на холоду из анилина образуется соль — анилинийгидросульфат. В дальнейшем при нагревании соль диссоциирует на исходные амин и кислоту, после чего происходит собственно сульфирование ароматического кольца:
Сульфирование анилина большим избытком серной кислоты или олеума, когда весь анилин протонирован, а электрофильной атаке подвергается катион анилиния, приводит к образованию метаниловой (3-аминобензолсульфоновой) кислоты. Обычно же это соединение получают восстановлением соответствующего нитросоединения.
|
|||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 2116; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.235.100 (0.008 с.) |