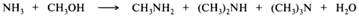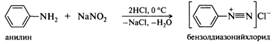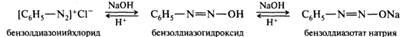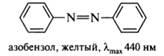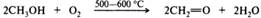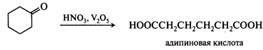Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Амины: классификация, номенклатура; химическая идентификация, спектральные характеристики. Представители: анилин, N–метиланилин, N,N–диметиланилин, толуидины, фенетидины, дифениламин.Содержание книги
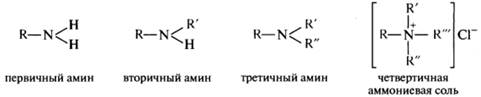
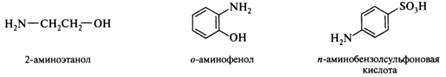
Поиск на нашем сайте Амины: классификация, номенклатура; химическая идентификация, спектральные характеристики. Представители: анилин, N–метиланилин, N,N–диметиланилин, толуидины, фенетидины, дифениламин. Аминами называются производные аммиака, в которых один, два иди три атома водорода заменены на углеводородные радикалы. В зависимости от числа углеводородных радикалов различают первичные, вторичные и третичные амины. Существуют также четвертичные аммониевые соли и основания, представляющие собой производные иона аммония, в котором все четыре атома водорода замещены органическими радикалами. По природе радикала амины подразделяются на алифатические и ароматические.
Для аминов более употребительны названия, построенные по радикально-функциональной, а не по заместительной номенклатуре. Родовое название амины относится к соединениям RNH2, RR'NH и RR'R"N, которые являются первичными, вторичными и третичными аминами соответственно. В более широком смысле к аминам относятся и соединения, содержащие группу —NH— в цикле. Названия первичных аминов образуются добавлением суффикса -амин к названию радикала R (способ а) или к названию родоначальной структуры (способ б). Так, соединение CH3CH2CH2NH2 будет называться пропиламин (а) или пропанамин-1 (б). Способ а обычно используют для производных простых соединений, а способ б — для сложных циклических соединений. В способе а применяется принцип замещения атома водорода в молекуле аммиака, который формально является родоначальной структурой. По сути он похож на принцип радикально-функциональной номенклатуры, но в правилах ИЮПАК относится к заместительной. В тех случаях, когда группа —NH2 не является старшей, она обозначается префиксом амино-:
Некоторые амины сохраняют тривиальные названия:
Первичные диамины и полиамины, в которых все аминогруппы присоединены к алифатической цепи или циклическому ядру, называют путем прибавления суффиксов -диамин, -триамин и т. д. к названию родоначальной структуры или многовалентного радикала. Тривиальное название «бензидин» сохраняется.
Симметричные вторичные и третичные амины называют, присоединяя умножающие приставки ди- или три- к названиям алкильных радикалов с суффиксом -амин. Несимметричные соединения получают названия как Ж-замещенные производные первичных аминов, причем за исходный первичный амин принимают соединение с более сложным радикалом:
Радикалы аминов RNH—, R2N—, RR'N— называют как замещенные аминогруппы или к тривиальным названиям аминов добавляют букву о:
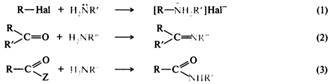
Низшие алифатические амины — газы или жидкости с запахом, похожим на запах аммиака. Высшие гомологи алифатических аминов и ароматические амины представляют собой жидкости или твердые вещества. Амины образуют слабые водородные связи и непрочные ассоциаты, поэтому их температуры кипения ниже, чем у спиртов и карбоновых кислот с тем же числом атомов углерода, но выше, чем у альдегидов или простых эфиров. Низшие алифатические амины хорошо растворимы в воде, с увеличением числа углеводородных радикалов и их длины растворимость снижается. Ароматические амины плохо растворимы в воде. Представители. Анилин — C6H5NH2 — бесцветная жидкость со слабым запахом, похожим на запах бензола, при стоянии на воздухе довольно быстро окисляется и приобретает желто-коричневую окраску и неприятный запах. Токсичен. Более половины производимого анилина расходуется на производство стабилизаторов и ускорителей вулканизации каучуков. Второй по значимости сферой его применения является производство изоцианатов, используемых для получения полиуретанов. Применяют также в производстве красителей различных классов, лекарственных средств, фотоматериалов и средств защиты растений. В нашей стране анилин используют для получения капролактама. N–метиланилин (монометиланилин) — С6H5NHCH3 — представляет собой маслянистую жидкость желтого цвета с плотностью 0,98 г/см3, растворимую в бензинах, спиртах и эфирах. Главной задачей монометиланилина является получение необходимых детонационных свойств бензина при его производстве. Кроме того, при добавлении его в топливо регулируется октановое число продукта и его экологичность. Диметиланилин — C6H5N(CH3)2 — третичный жирноароматический амин, бесцветная жидкость. Применяется в производстве полиэфирных смол и в органическом синтезе. Диметиланилин применяют в синтезе красителей (малахитовый зелёный, метиленовый голубой и др.), взрывчатых веществ и др. Толуидины — CH3C6H4NH2 — бесцветные кристаллические соединения со своеобразными запахами, на воздухе быстро окисляются и темнеют. Получают восстановлением нитротолуолов. Применяют в производстве красителей разных классов (трифенилметановых, азокрасителей, тиазиновых, сернистых), а также для получения крезолов. Толуидины, как и некоторые другие ароматические амины, ядовиты и канцерогенны. Фенетидины (этоксианилины, аминофенетолы) — NH2–C6H4–OC2H3 (орто-, пара- и мета-) — представляют жидкости. Применяют в производстве азотолов; n-фенетидин также в синтезе лекарственныз средствв (фенацетина, риванола). Фенетидины вызывают отравление при попадании на кожу и вдыхании паров, поражают печень и почки. Дифенилами́н ((N-фенил)-анилин) — (С6Н5)2NН — бесцветные кристаллы, темнеющие на свету. Дифениламин — исходный продукт в производстве антиоксидантов для полимеров; стабилизатор и флегматизатор термо- и атмосферостойкости нитратов целлюлозы, в том числе пироксилиновых порохов; промежуточный продукт в синтезе триарилметановых и азокрасителей, инсектицидов; ингибитор коррозии мягких сталей. Используется в аналитической химии для обнаружения ионов, как окислительно-восстановительный индикатор. Нуклеофильные свойства. Нуклеофильные свойства аминов, как и основные, обусловлены наличием неподеленной пары электронов атома азота. Некоторые реакции, в которых амины участвуют в качестве нуклеофильных реагентов, будут далее и были ранее. Это — алкилирование аминов [(1)], взаимодействие с карбонильными соединениями [(2)] и ацилирование производными карбоновых кислот [(3)]:
Алкилирование. Амины, как и аммиак, подвергаются алкилированию галогеноалканами. Алкилирование аммиака приводит к образованию первичного амина, из первичных аминов образуются вторичные, из вторичных — третичные, из третичных — четвертичные аммониевые соли. Образующаяся в ходе реакции замещенная аммониевая соль обменивается протоном с аммиаком или амином, поэтому в реакции алкилирования получается смесь аминов с разным числом алкильных радикалов:
Реакцию алкилирования редко удается остановить на какой-то отдельной стадии ввиду того, что различия в нуклеофильности и основности первичных, вторичных и третичных аминов не настолько значительны, чтобы повлиять на различие в скоростях реакций алкилирования аминов разной степени замещения. В промышленности аммиак и низшие амины алкилируют низшими спиртами в газовой фазе при температуре 300—500 °С над оксидами алюминия, кремния, тория, хрома и др. При этом образуются смеси первичных, вторичных и третичных аминов. Этим способом получают в основном метил- и этиламины:
Реакции аминов с эпоксидами. При взаимодействии первичных и вторичных аминов с эпоксидами (оксиранами) происходит нуклеофильное раскрытие напряженного трехчленного α-оксидного цикла и образуются β-аминоспирты. В замещенных эпоксидах нуклеофильная атака происходит, как правило, на наименее замещенный атом углерода оксидного цикла (правило Красуского):
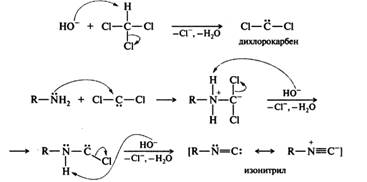
29. Амины: реакции первичных, вторичных и третичных алифатических и ароматических аминов с азотистой кислотой; карбиламинная реакция (изонитрильная проба). Нуклеофильные свойства. Карбиламинная (изонитрильная) реакция (качественная реакция). При взаимодействии первичных аминов с хлороформом в спиртовом растворе щелочи образуются изонитрилы (карбиламины):
Первоначально из хлороформа при действии щелочи в результате α-элиминирования образуется дихлорокарбен — электронодефицитная частица с секстетом электронов у атома углерода. Затем происходит нуклеофильное присоединение амина к дихлорокарбену, после в результате последовательного отщепления 2 молекул HCl образуется изонитрил:
Изонитрилы представляют собой жидкости с отвратительным тошнотворным запахом, ядовиты. Они нестойки, разлагаются при действии кислот на исходный первичный амин и муравьиную кислоту. Карбиламинную реакцию применяют в аналитических целях для обнаружения первичных аминов. Реакции с азотистой кислотой. Амины разных типов с азотистой кислотой реагируют неодинаково. Некоторые продукты этих реакций, например соли диазония, имеют широкое практическое применение. Первичные ароматические амины. В результате реакции первичных ароматических аминов с азотистой кислотой при низких температурах в присутствии сильных минеральных кислот образуются соли арилдиазония, а сама реакция называется реакцией диазотирования:
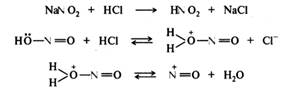
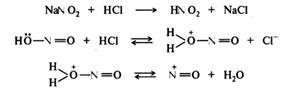
Реакция диазотирования имеет сложный механизм. Показано, что она имеет третий порядок, а скорость ее зависит от концентрации свободного амина (основания), азотистой и сильной минеральной кислот. Нитрозирующей частицей (электрофилом) в этой реакции в зависимости от условий проведения могут быть протонированная форма азотистой кислоты H2O+NO; оксид азота(III) N2O3; нитрозилхлорид NOC1 или нитрозил-катион N=O+, образующиеся из нитрита натрия и минеральной кислоты:
В сильнокислой среде нитрозирующей частицей является нитрозил-катион, который взаимодействует со свободным амином, находящимся в равновесии с аммониевым ионом. Необходимо акцентировать, что электрофильной атаке подвергается именно свободный амин, а не его соль, несмотря на то что концентрация его в сильнокислой среде может быть очень низкой:
Образующийся катион (I) отщепляет протон и превращается в N-нитрозоамин (II), который перегруппировывается в диазогидроксид (III). Диазогидроксид протонируется и отщепляет воду, превращаясь в катион диазония (IV):
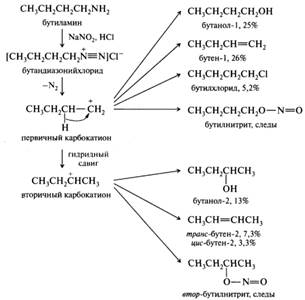
Условия диазотирования конкретного амина зависят от двух факторов — основности и растворимости в воде. Амины с относительно высокой основностью и хорошей растворимостью в воде диазотируют в разбавленных растворах в слабокислой среде. В этих условиях в растворе создается достаточно высокая концентрация свободного амина, а в качестве нитрозирующих агентов выступает свободная или протонированная азотистая кислота, а также оксид азота(III). Амины с низкой основностью, например нитроанилины, диазотируют в концентрированной серной кислоте, в этой среде образуется более сильный электрофил — нитрозил-катион. Ароматические соли диазония — неустойчивые соединения, в сухом виде взрывчаты, большинство из них хорошо растворимы в воде, поэтому их получают в водных растворах и сразу же используют для дальнейших превращений. Первичные алифатические амины. Эти амины при действии азотистой кислоты в водных растворах подвергаются дезаминированию. Вначале они, как и ароматические амины, образуют соли диазония, однако последние крайне неустойчивы и разлагаются даже в растворах и при низких температурах. Катион алкилдиазония отщепляет молекулу азота и превращается в соответствующий карбокатион. Образовавшийся карбокатион присоединяет различные нуклеофилы, имеющиеся в реакционной смеси (воду, хлорид- или нитрит-ион), отщепляет протон и превращается соответственно в спирт, алкилгалогенид, нитрозоэфир или этиленовый углеводород. Кроме того, карбокатионы могут претерпевать различные перегруппировки. Перегруппировочные карбокатионы в свою очередь также могут отщеплять протон и присоединять различные нуклеофилы. Таким образом, в результате дезаминирования первичных алифатических аминов образуется, как правило, сложная смесь продуктов, что иллюстрируется схемой дезаминирования бутиламина:
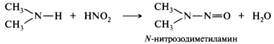
Вторичные амины. Алифатические и ароматические вторичные амины при взаимодействии с азотистой кислотой образуют N-нитрозоамины, представляющие собой нерастворимые в воде маслянистые жидкости или твердые вещества желтого цвета. Эту реакцию можно использовать для идентификации вторичных аминов:
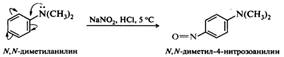
Третичные ароматические амины. Электрофильной атаке нитрозирующим агентом подвергается ароматическое кольцо, при этом образуются пара-нитрозопроизводные:
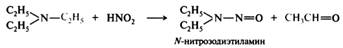
Третичные алифатические амины. При низких температурах и низкой концентрации азотистой кислоты третичные алифатические амины не реагируют. При нагревании происходит дезалкилирование третичного амина с образованием вторичного N-нитрозоамина и окислением отщепившегося радикала в соответствующий альдегид:
Номенклатура. Используемый термин «родоначальная молекула» (не путать с родоначальной структурой!) подразумевает молекулы RH и R'H, производными которых будут азосоединения R—N=N—R'. Названия соединений, в которых азогруппа — N=N— связывает радикалы, производимые от идентичных родоначальных молекул без заместителей, образуются добавлением префикса азо- к названию незамещенной родоначальной молекулы. Заместители обозначаются с помощью префиксов и суффиксов обычным способом. Азогруппа получает наименьшие локанты. Один набор локантов отмечается штрихами:
В тех случаях, когда азогруппа связывает различные радикалы, в названии азосоединения частицу азо- помещают между полными наименованиями родоначальных молекул (замещенных). Если необходимы цифровые указатели для обозначения положения азогруппы, то их помещают между частицей азо- и названиями молекул, к которым эти локанты относятся. Первой указывается более сложная родоначальная молекула. Азогруппа получает наименьшие возможные локанты. Все заместители в первом компоненте обозначаются префиксами (за исключением тех, которые включаются в тривиальное или полутривиальное название этого компонента). Локанты в первом компоненте обозначаются цифрами без штрихов, а во втором — со штрихами:
Другой способ – в названии соединений RN=NR' радикал RN=N— рассматривают как заместитель в родоначальной молекуле R'H. В качестве R'H выбирают такую молекулу, которая имеет большее число старших характеристических групп. Если их число в обоих компонентах одинаково, то за R'H принимают более сложную молекулу, а группу RN=N— называют R-азо-. Суффикс должен получить наименьший возможный локант; следующие, насколько возможно, низкие номера должна иметь азогруппа:
Если радикалы R и R' образованы из одной и той же незамещенной родоначальной молекулы и несут одинаковое число характеристических групп, обозначаемых суффиксами, то названию незамещенного азосоединения предшествует префикс азоди-, а перед ним перечисляются префиксы других заместителей. Суффикс, а за ним азогруппа должны иметь по возможности меньшие локанты. Как и в первом способе, используются цифровые указатели со штрихами и без них:
Реакции аминов с азотистой кислотой. Первичные ароматические амины. В результате реакции первичных ароматических аминов с азотистой кислотой при низких температурах в присутствии сильных минеральных кислот образуются соли арилдиазония, а сама реакция называется реакцией диазотирования:
Реакция диазотирования имеет сложный механизм. Показано, что она имеет третий порядок, а скорость ее зависит от концентрации свободного амина (основания), азотистой и сильной минеральной кислот. Нитрозирующей частицей (электрофилом) в этой реакции в зависимости от условий проведения могут быть протонированная форма азотистой кислоты H2O+NO; оксид азота(III) N2O3; нитрозилхлорид NOC1 или нитрозил-катион N=O+, образующиеся из нитрита натрия и минеральной кислоты:
В сильнокислой среде нитрозирующей частицей является нитрозил-катион, который взаимодействует со свободным амином, находящимся в равновесии с аммониевым ионом. Необходимо акцентировать, что электрофильной атаке подвергается именно свободный амин, а не его соль, несмотря на то что концентрация его в сильнокислой среде может быть очень низкой:
Образующийся катион (I) отщепляет протон и превращается в N-нитрозоамин (II), который перегруппировывается в диазогидроксид (III). Диазогидроксид протонируется и отщепляет воду, превращаясь в катион диазония (IV):
Условия диазотирования конкретного амина зависят от двух факторов — основности и растворимости в воде. Амины с относительно высокой основностью и хорошей растворимостью в воде диазотируют в разбавленных растворах в слабокислой среде. В этих условиях в растворе создается достаточно высокая концентрация свободного амина, а в качестве нитрозирующих агентов выступает свободная или протонированная азотистая кислота, а также оксид азота(III). Амины с низкой основностью, например нитроанилины, диазотируют в концентрированной серной кислоте, в этой среде образуется более сильный электрофил — нитрозил-катион. Ароматические соли диазония — неустойчивые соединения, в сухом виде взрывчаты, большинство из них хорошо растворимы в воде, поэтому их получают в водных растворах и сразу же используют для дальнейших превращений. Ароматические диазосоединения. Более значимыми в практическом отношении являются диазосоединения ароматического ряда. Общая формула ароматических диазосоединений ArN2X, где X — анион сильной кислоты или ковалентносвязанная группа, например, гидроксильная. Строение диазосоединения существенно зависит от характера частицы X. В тех случаях, когда она представляет собой анион сильной кислоты (HSО4—, Сl—, СlO4—), диазосоединение существует в виде ионно построенной соли диазония. Атомы азота в катионе диазония линейно расположены в плоскости бензольного кольца. Расстояние между атомами азота приблизительно равно 0,109 нм, т. е. по характеру эта связь приближается к тройной. Положительный заряд в катионе распределен в основном на обоих атомах азота, но частично он компенсируется и за счет π-электронного облака ароматического кольца, и таким образом, можно представить следующие резонансные структуры катиона бензолдиазония:
Поскольку первые две структуры вносят наибольший вклад в резонансный гибрид, то катион арилдиазония часто записывается как ArN2+. Соли диазония устойчивы только при низких температурах (0—5 °С). В сухом виде взрываются даже при низких температурах, поэтому их растворы, как правило водные, готовят по мере надобности и долго не хранят. Комплексы солей диазония с некоторыми кислотами Льюиса — двойные диазониевые соли — сравнительно устойчивы и могут довольно долго сохраняться в сухом виде при комнатной температуре. К ним относятся соли с такими анионами, как BF4—, ZnCl3—, SbCl4—, SbCl6—, HgCl3—, FeCl4—, например:
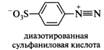
Соли диазония, получаемые из ариламиносульфоновых кислот, существуют в виде диполярных ионов; вероятно, поэтому многие из них малорастворимы в воде.
Строение диазосоединений зависит от pH среды: в кислой среде они существуют в виде солей диазония, при подщелачивании раствора соли диазония превращаются в ковалентно построенные диазогидроксиды. Диазогидроксиды обладают кислотными свойствами, поэтому при дальнейшем добавлении щелочи они отщепляют протон и образуют соли — диазотаты. При подкислении растворов диазотатов снова образуются диазогидроксиды и соли диазония:
Индикаторные свойства. Еще более ста лет назад окраску веществ связывали с наличием в их структуре так называемых хромофорных групп, к которым относятся некоторые ненасыщенные группировки, например, двойные связи С=С, С=O, C=N, N=N, N=O, ароматические фрагменты. Изолированные хромофоры имеют полосы поглощения в электронном спектре в дальней ультрафиолетовой области (165—200 нм) и являются прозрачными в видимой области спектра. Сопряжение одного хромофора с другим вызывает сдвиг полос поглощения в сторону больших длин волн с одновременным увеличением их интенсивности. Окрашенные вещества поглощают в видимой области спектра (400—800 нм). Очевидно, что такие соединения должны иметь в своей структуре длинную цепь сопряжения. Типичным примером окрашенных веществ служат азосоединения, характеризующиеся наличием в структуре в качестве главного хромофора фрагментаазобензола. Сопряженная система азобензола включает два бензольных кольца и азогруппу:
Различные азосоединения в зависимости от длины сопряженной системы могут быть окрашены в желтый, оранжевый, красный, синий и зеленый цвета. Изменению и углублению окраски способствует наличие в структуре ауксохромов — атомов или групп атомов, вступающих в р,π- и π,π-сопряжение с π-электронной системой главного хромофора. Наиболее интенсивную окраску имеют те соединения, в которых с главным хромофором сопряжены одновременно электронодонорные и электроноакцепторные группы, находящиеся в пара- или орто-положении по отношению друг к другу. Примерами таких соединений могут служить метиловый оранжевый (гелиантин), имеющий электронодонорную диметиламиногруппу, и электроноакцепторную сульфогруппу, а также метиловый красный, конго красный и др. Многие ароматические азосоединения при действии кислот и оснований изменяют свою окраску в определенном интервале pH среды, благодаря чему используются в аналитической химии как индикаторы. При изменении pH происходит протонирование или депротонирование молекулы индикатора, что влечет за собой перераспределение электронной плотности в сопряженной системе. Например, индикатор метиловый оранжевыйв нейтральной и щелочной средах окрашен в желтый цвет. В кислой среде вследствие протонирования одного из атомов азота происходит изменение в распределении электронной плотности в сопряженной системе молекулы, являющееся причиной изменения желтой окраски на красную. Протонированная форма молекулы метилового оранжевого может быть описана двумя мезомерными структурами, одна из которых хиноидная. Полагают, что изменение окраски в основном обусловлено вкладом хиноидной структуры (выделена цветом):
Имеется большое число кислотно-основных индикаторов, относящихся к разным классам окрашенных веществ, интервалы перехода окраски которых перекрывают весь диапазон значений pH. Большую ценность представляют индикаторы с узким интервалом перехода, например нитразиновый желтый. Альдегиды и кетоны: классификация; номенклатура; химическая идентификация, спектральные характеристики. Представители: формальдегид (формалин), ацетальдегид, хлораль (хлоральгидрат), акролеин, бензальдегид, ацетон, циклогексанон, ацетофенон.
Альдегидами называются соединения, в которых карбонильная группа соединена с углеводородным ради капом и атомом водорода, а кетонами карбонильные соединения с двумя углеводородными радикалами. В альдегидах и кетонах функциональной группой является карбонильная группа >С=O, поэтому оба класса этих родственных веществ относятся к карбонильным соединениям:
В зависимости от строения углеводородных радикалов альдегиды и кетоны бывают алифатическими (насыщенными и ненасыщенными) и ароматическими. Кетоны, у которых карбонильная группа соединена с одинаковыми углеводородными радикалами, называются симметричными. Номенклатура. Родовое название альдегиды имеют соединения, у которых группа — СН=О присоединена к атому углерода. В названиях ациклических альдегидов группа —СНО, если она является старшей и находится в главной цепи, обозначается суффиксом -аль. Нумерация ведется в этом случае от нее, поэтому локант «1» опускается. Диальдегиды называют путем добавления суффикса -диаль к названию родоначальной структуры. Если группа —СНО не является старшей или находится не в главной цепи, то используют префикс формил-.
Названия циклических альдегидов, в которых группа —СНО как старшая связана с циклом, строятся добавлением суффикса -карбальдегид к названию циклической системы:
Если соответствующая альдегиду карбоновая кислота имеет тривиальное название, то из него может быть образовано и тривиальное название альдегида:
Сохраняются следующие тривиальные названия:
Родовое название кетоны имеют соединения, содержащие карбонильную группу >С=О, связанную с двумя атомами углерода (оксогруппой называется фрагмент =O). Кетоны называют, используя суффикс -он, если нет более старшей группы. В ее присутствии используется префикс оксо-.
Сохраняется тривиальное название «ацетон» для СН3СОСН3. Кетоны Ar— СО—R, в которых карбонильная группа присоединена к бензольному или нафталиновому ядру, называют, заменяя частицу -ил в названии ацильного радикала R—СО— на суффиксы -офенон и -онафтон соответственно:
Дикетоны, производимые от ароматических соединений заменой двух фрагментов — СН= на группы >С=O с последующей перегруппировкой двойных связей, называют, добавляя суффикс -хинон к названию ароматического соединения (иногда это название подвергают модификации):
Низшие алифатические альдегиды и кетоны, за исключением газообразного формальдегида, представляют собой подвижные жидкости. Первые представители (формальдегид, ацетальдегид, ацетон) хорошо растворимы в воде за счет образования с ней водородных связей или гидратных форм. По мере удлинения углеродной цепи растворимость карбонильных соединений в воде снижается. Ароматические карбонильные соединения плохо растворимы в воде.
Отдельные представители. Формальдегид — СН2О — простейший и единственный газообразный альдегид, обладает резким раздражающим запахом, хорошо растворим в воде и спиртах, хуже в эфире, бензоле. В промышленности формальдегид получают парофазным окислением метанола, железо-молибденовые катализаторы обеспечивают выходы до 92%:
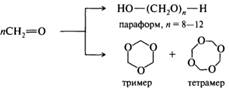
Формальдегид склонен к полимеризации, в зависимости от условий образуется линейный олигомер (параформальдегид, или параформ) или циклические тример и тетрамер. Параформ представляет собой белый порошок, при нагревании разлагается с образованием формальдегида, поэтому используется как форма хранения и транспортировки формальдегида.
При взаимодействии формальдегида с аммиаком образуется гексаметилентетрамин (уротропин). Первоначально образующийся продукт нуклеофильного присоединения аммиака к альдегиду в несколько стадий превращается в уротропин, каркасная структура которого сходна с кристаллической решеткой алмаза:
Гексаметилентетрамин используется в медицине как антисептическое средство. Основная масса производимого промышленностью формальдегида используется для производства феноло- и мочевиноформальдегидных смол. Водный 40%-й раствор формальдегида, стабилизированный добавкой 6—10% метанола, называется формалином (антисептик). Ацетальдегид — СН3СНО — низкокипящая жидкость с резким запахом, смешивается во всех отношениях с водой и большинством органических растворителей. Ацетальдегид, подобно формальдегиду, в присутствии кислот легко образует циклический тример (паральдегид) и тетрамер (метальдегид):
Метальдегид используется в качестве топлива (сухой спирт). Ацетальдегид служит сырьем для промышленного получения многих соединений алифатического ряда — уксусной кислоты, уксусного ангидрида, этилацетата, бутанола-1, хлораля. Хлораль (трихлорацетальдегид, трихлоруксусный альдегид) — CCl3CHO — бесцветная жидкость со специфическим резким запахом, растворим в органических растворителях и нерастворим в воде. Хлораль используют в производстве инсектицидов, в частности в производстве ДДТ, хлорофоса, дихлофоса. Хлоральгидрат (2,2,2-трихлорэтандиол-1,1, C(Сl)3С(ОН)2Н) обладает снотворным и седативным действием, использующихся при анестезии. Чаще хлоралгидрат используется при психическом возбуждении и как противосудорожное средство при спазмофилии,столбняке и т. п. Входит в состав зубных капель «Дента». Бензальдегид — С6Н5СНО — бесцветная жидкость с запахом горького миндаля. Пары бензальдегида обладают слезоточивым действием. Растворим в этаноле, диэтиловом эфире и других органических растворителях, практически нерастворим в воде. В природе встречается в виде гидроксинитрила C6H5CH(OH)CN (как составная часть амигдалина). Бензальдегид используют для синтеза коричной кислоты и альдегида, бензилбензоата, трифенилметановых красителей. Акролеин (акриловый альдегид) — СН2=СНСНО — простейший ненасыщенный альдегид, представляющий собой бесцветную слезоточивую жидкость с резким запахом, образуется при термическом разложении жиров (кухонный чад), растворим в воде и органических растворителях. Акриловый альдегид легко полимеризуется и окисляется, поэтому его хранят в присутствии ингибиторов радикальных реакций. Применяют акриловый альдегид для синтеза акрилонитрила, глицерина, пиридина, некоторых аминокислот. Ацетон — СН3СОСН3 — простейший кетон, бесцветная жидкость с характерным запахом, смешивается с водой и органическими растворителями. Образуется как продукт аномального расщепления углеводов у больных сахарным диабетом (ацетоновые тела). Ацетон находит широкое применение как растворитель лаков и красок, служит сырьем для синтеза уксусного ангидрида и кетена СН2=С=О. Ацетофенон (метилфенилкетон) — C6H5COCH3 — бесцветная маслянистая жидкость, обладающая сильным запахом черёмухи. Хорошо растворяется в этаноле, диэтиловом эфире, ацетоне, хлороформе, бензоле. Ацетофенон и некоторые его производные используются как душистые вещества в парфюмерии. Кроме того, ацетофенон обладает снотворным действием. Его производное — хлорацетофенон — является слезоточивым веществом. Циклогексанон — жидкость с раздражающим запахом (ацетон и мята), растворим в органических растворителях, ограниченно растворим в воде. Получают гидрированием фенола с последующим окислением или дегидрированием циклогексанола. Применяют для получения ɛ-капролактама и адипиновой кислоты, например:
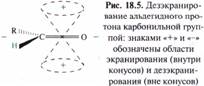
Спектральная идентификация ИК-спектроскопия. В ИК-спектрах альдегидов и кетонов имеется сильная полоса валентных колебаний группы С=О. У алифатических альдегидов максимум полосы поглощения находится около 1725 см-1, у кетонов 1715 см-1. Если карбонильная группа сопряжена с С = С или ароматической системой, максимум полосы поглощения смещается в низкочастотную область: у ароматических альдегидов — 1715-1695 см-1, у α,β-ненасышенных альдегидов — 1710-1685 см-1, у алкил-арилкетонов — около 1690 см-1, у диарилкетонов — около 1665 см-1, у α,β-ненасыщенных кетонов — ~1665 см-1. Для карбонильных групп хинонов характерна полоса поглощения при 1690—1660 см-1. Две полосы слабой интенсивности в области 2720-2690 и 2830-2810 см-1 соответствует валентным колебаниям связи С—Н альдегидов. Спектроскопия ПМР. В спектрах ПМР альдегидов наиболее характеристичными являются сигналы протона альдегидной группы в интервале 9,4-10,4 м. д. (9,72 м. д. у ацетальдегида, 9,48 м. д. у акрилового альдегида, 9,96 м. д. у бензальдегида). Нахождение этого сигнала в столь слабом поле обусловлено магнитной анизотропией карбонильной группы. Внешнее магнитное поле Н0 индуцирует в π-электронной системе связи С=О циркуляцию электронов, которая в свою очередь создает области, где протоны подвергаются соответственно экранированию и дезэкранированию.
Карбонильная группа за счет индуктивного эффекта дезэкранирует протоны у α-атомов углерода альдегидов и кетонов. Сигналы метальных протонов групп, непосредственно связанных с карбонильной группой, наблюдаются в интервале от 1,9 до 2,2 м, д. (2,07 м. д. у ацетона, 1,93 м. д. у ацетальдегида). Метиленовые группы дают сигнал в более слабом поле, например, в спектре пропионового альдегида протоны метиленовой группы дают сигнал 2,40 м. д. В спектрах ПМР хинонов протоны кольца дают сигналы в области 6,7 м. д. Электронная спектроскопия. Насыщенные и несопряженные альдегиды и кетоны имеют в УФ-спектре малоинтенсивную полосу поглощения 270—290 нм, обусловленную n→π*-переходом. Положение полосы n→π*-перехода зависит от растворителя; в полярных растворителях максимум поглощения смещается в коротковолновую область. Водородные связи, образуемые протонными растворителями (вода, спирты) с альдегидами и кетонами, понижают энергию несвязывающих электронов карбонильного атома кислорода. На возбуждение таких электронов требуется большая энергия, а значит, более жесткое излучение, с меньше
|
||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 2663; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.220 (0.011 с.) |