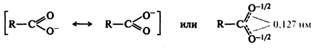Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Альдегиды и кетоны: реакции восстановления – гидридами и комплексными гидридами, восстановление по кижнеру–вольфу и клемменсену; реакции окисления альдегидов катионами серебра (i) и меди (II).Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
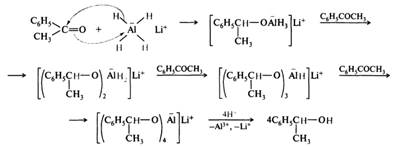
Восстановление. Карбонильные соединения могут быть восстановлены в спирты. Альдегиды восстанавливаются в первичные спирты, кетоны — во вторичные. Некоторые методы позволяют восстановить карбонильную группу в метиленовую. Восстановление комплексными гидридами металлов. Важнейшими современными способами восстановления карбонильных соединений в спирты является использование в качестве восстановителей комплексных гидридов металлов — алюмогидрида лития Li[AlH4], борогидрида натрия Na[BH4] и их производных — триметоксиалюмогидрида лития Li[AlH(OCH3)3], цианоборогидрида натрия Na[B(CN)H3], триэтилборогидрида лития Li[BH(C2H5)3] и др., например:
Хорошие результаты также дает использование гидридов алюминия и бора и их производных. Ценность метода состоит в том, что в этих условиях не восстанавливаются кратные связи С=С и С≡С (хотя сопряженные с карбонильной группой двойные связи иногда восстанавливаются). Следует учитывать, что цианогруппа — C≡N, нитрогруппа —NО2 и сложноэфирная группа — COOR восстанавливаются гидридами металлов легче карбонильных групп альдегидов и кетонов. Алюмогидрид лития разлагается водой и спиртами, поэтому реакцию проводят в безводных растворителях. Борогидрид натрия устойчив к действию протонных растворителей, и восстановление ими проводят в спиртовых растворах и даже в воде. Ключевой стадией является нуклеофильное присоединение комплексного аниона к карбонильной группе, при этом гидрид-ион присоединяется к карбонильному атому углерода. Все атомы водорода комплексного аниона расходуются на восстановление, на каждой из 4-x последовательных стадий в качестве восстановителя выступает новый анион.
Каталитическое гидрирование. Альдегиды и кетоны восстанавливаются в спирты:
Наряду с карбонильной группой могут восстанавливаться связи С=С, С≡С, C=N, C≡N, нитрогруппа, сложноэфирная группа. Восстановление по Клемменсену. Амальгамированный цинк в концентрированной хлороводородной кислоте восстанавливает карбонильную группу альдегидов и кетонов в группу СН2:
Восстановление по Кижнеру-Вольфу. Гидразоны, получаемые из альдегидов и кетонов, подвергаются термическому разложению в присутствии сильных оснований в среде высококипящих растворителей (например, этиленгликоля):
Реакции восстановления по Кижнеру-Вольфу и Клемменсену удачно дополняют друг друга: одна из них осуществляется в щелочной среде, другая — в кислой, что имеет значение при наличии в восстанавливаемом соединении тех или иных функциональных групп, которые могут быть чувствительны к действию кислоты или щелочи. Окисление. Альдегиды окисляются значительно легче кетонов. Альдегиды практически любыми способами окисляются в карбоновые кислоты. Кетоны в зависимости от окислителя дают соединения разных классов, их окисление в основном сопровождается разрывом углеродного скелета. Оксид серебра в виде аммиачного комплекса [Ag(NH3)2]OH, известный как реактив Толленса, окисляет альдегиды в карбоновые кислоты, при этом выделяется металлическое серебро, отсюда название — реакция «серебряного зеркала» (качественная реакция).
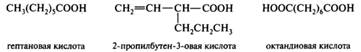
Аналогичным образом ведет себя комплекс гидроксида меди(II) с винной кислотой — реактив Фелинга (качественная реакция). Оба реагента не затрагивают двойные связи. Эти две простые в исполнении реакции применяют для обнаружения альдегидов, причем реактив Фелинга не взаимодействует с ароматическими альдегидами. Карбоновые кислоты: классификация; номенклатура; строение карбоксильной группы; химическая идентификация, спектральные характеристики. Представители: муравьиная, уксусная, пропионовая, масляная, изовалериановая, акриловая, метакриловая, бензойная, коричная кислоты. Карбоновыми кислотами называются соединения, в которых функционалной группой является карбоксильная группа— СООН. По числу карбоксильных групп в молекуле различают монокарбоновые, дикарбоновые, трикарбоновые кислоты и т. д. В зависимости от строения углеводородного радикала, связанного с карбоксильной группой, кислоты подразделяются на алифатические (насыщенные и ненасыщенные), алициклические, ароматические, гетероциклические. В систематических названиях алифатических карбоновых кислот карбоксильная группа обозначается суффиксом -овая кислота к названию родоначального углеводорода с тем же числом атомов углерода. Названия дикарбоновых кислот включают суффикс -диовая кислота. Нумерация всегда начинается от атома углерода карбоксильной группы, поэтому ее локант опускается:
Менее предпочтительны названия моно- и дикарбоновых кислот, в которых группа —СООН выступает как заместитель, обозначаемый суффиксом -карбоновая кислота. Однако этот принцип рекомендуется для кислот, содержащих более двух карбоксильных групп, присоединенных к неразветвленной цепи. При этом атомы углерода карбоксильных групп не нумеруются. Тот же суффикс как единственно возможный используется в названиях кислот циклического ряда, где атом углерода карбоксильной группы не может быть включенным в цикл.
Для первых пяти представителей насыщенных алифатических моно- и дикарбоновых кислот правилами ИЮПАК рекомендуется использование тривиальных названий, например, название «уксусная кислота» предпочтительнее названия «этановая кислота».
Для первого представителя ароматических кислот С6Н5СООН правилами ИЮПАК сохранено название бензойная кислота. Поэтому замещенные ароматические монокарбоновые кислоты называют, используя бензойную кислоту в качестве родоначальной структуры:
Ацильные радикалы монокарбоновых кислот, образующиеся после удаления гидроксильной группы от карбоксильной, называют, заменяя суффикс -овая кислота на -оил. Ацильные радикалы дикарбоновых кислот, полученные удалением обеих гидроксильных групп, получают суффикс -диоил. Для кислот с суффиксом -карбоновая кислота ацильные радикалы RCO— называют R-карбонил—.
Кислоты, содержащие группу —С(О)ООН, называются пероксикислотами. В индивидуальных названиях префикс перокси- помещают перед названием соответствующей карбоновой кислоты (тривиальным или с суффиксом -овая кислота); в названиях с суффиксом -карбоновая кислота частицу перокси- помещают перед этим суффиксом. Однако для наиболее распространенных пероксикислот сохраняются укоренившиеся названия: перуксусная кислота СН3С(О)ООН и пербензойная кислота С6Н5С(О)ООН (в русской терминологии они называются также надуксусной и надбензойной кислотами соответственно). Монокарбоновые кислоты с числом атомов углерода от 1 до 9 представляют собой бесцветные жидкости; ароматические, высшие алифатические и практически все дикарбоновые кислоты — твердые вещества. Муравьиная, уксусная и пропионовая кислоты имеют резкий раздражающий запах, при попадании на слизистые оболочки вызывают ожоги. Кислоты с большим числом атомов углерода пахнут неприятно. Высшие монокарбоновые и дикарбоновые кислоты из-за низкой летучести запаха не имеют. Водородные связи, возникающие в карбоновых кислотах, относятся к числу самых прочных среди других водородных связей; их энергия равна 29 кДж/моль. Низшие члены гомологического ряда монокарбоновых алифатических кислот — муравьиная, уксусная и пропионовая — смешиваются с водой в любых соотношениях. Растворимость в воде высших гомологов уменьшается по мере удлинения углеводородного радикала. В ряду дикарбоновых алифатических кислот наблюдаются те же закономерности: низшие гомологи лучше растворяются в воде, чем высшие. Ароматические карбоновые кислоты плохо растворимы в воде и значительно лучше — в этаноле. Химические свойства. Карбоксильная группа представляет собой р,π-сопряженную систему, возникающую в результате взаимодействия р-орбитали атома кислорода гидроксильной группы с р-орбиталью атома углерода карбонильной группы:
В результате сопряжения происходит некоторое выравнивание длин связей в карбоксильной группе — двойная связь С=О длиннее таковой в альдегидах и кетонах, а одинарная связь С—О, наоборот, короче связи С—О в спиртах или простых эфирах. Эффектом сопряжения можно объяснить также большой барьер вращения вокруг простой связи С—О (71 кДж/моль). В молекулах карбоновых кислот можно выделить ряд реакционных центров: • ОН-кислотный центр, за счет которого карбоновые кислоты проявляют кислотные свойства в реакциях с основаниями; • электрофильный центр — атом углерода карбоксильной группы, при участии которого карбоновые кислоты и их функциональные производные вступают в реакции нуклеофильного замещения; • основный центр — оксогруппа со своей неподеленной парой электронов, которая протонируется на стадии катализа в реакциях нуклеофильного замещения; • СН-кислотный центр, возникающий у α-атома углерода за счет индуктивного эффекта карбоксильной группы.
Представители. Муравьиная кислота — НСООН — простейший представитель кислот алифатического ряда. Название связано с тем, что она обнаружена в выделениях муравьев, содержится она также в волосках листьев крапивы. Соли и сложные эфиры муравьиной кислоты имеют название формиаты. В промышленности муравьиную кислоту получают гидролизом формамида или взаимодействием оксида углерода(II) с горячим раствором гидроксида натрия при повышенном давлении:
Муравьиная кислота, в отличие от других карбоновых кислот, обладает восстановительными свойствами, восстанавливает оксид серебра (реакция «серебряного зеркала») и гидроксид меди(II) — качественная реакция. В органических реакциях часто используется в качестве восстановителя. Под действием концентрированной серной кислоты муравьиная кислота дегидратируется с образованием оксида углерода(II):
Муравьиную кислоту используют как консервант в пищевой промышленности и в сельском хозяйстве, в текстильном и кожевенном производстве. Эфиры и амиды муравьиной кислоты применяют в качестве растворителей. Уксусная кислота — СН3СООН — известное с глубокой древности вещество, ее 3—6%-е растворы (столовый уксус) используют как вкусовую приправу и консервант — создаваемая ею кислая среда подавляет развитие гнилостных бактерий и плесневых грибов. Чистая уксусная кислота представляет собой прозрачную жидкость с резким раздражающим запахом, при попадании на кожу и слизистые оболочки вызывает ожоги. При температуре 16,6 °С она затвердевает, поэтому ее называют «ледяной» уксусной кислотой. Соли и эфиры уксусной кислоты называются ацетатами. В промышленности уксусную кислоту получают каталитическим окислением бутана кислородом воздуха. Значительные количества уксусной кислоты производят путем окисления ацетальдегида. Пищевую уксусную кислоту получают микробиологическим окислением этанола (уксуснокислое брожение). Основная часть производимой уксусной кислоты расходуется на производство искусственных волокон на основе целлюлозы (ацетатное волокно). Эфиры уксусной кислоты применяют в качестве растворителей лаков и красок. Соли (ацетат свинца, основной ацетат алюминия), эфиры (ацетилсалициловая кислота, бисакодил, ацеклидин) и амиды (фенацетин, парацетамол) применяются в медицине в качестве лекарственных средств. Пропионовая кислота (пропановая кислота, метилуксусная кислота) — С2Н5СООН — бесцветная едкая жидкость с резким запахом. Пропионовая кислота названа так, потому что она является наименьшей H(CH2)nCOOH кислотой, проявляющей свойства жирных кислот. В природе найдена в нефти, образуется при брожении углеводов. Пропионовая кислота и ее производные применяют в производстве гербицидов, лекарственных средств (ибупрофен, феноболин и др.), душистых веществ, пластмасс (поливинилпропионата), растворителей, винилпластификаторов и ПАВ. Пропионовая кислота препятствует росту плесени и некоторых бактерий – используется как консервант. Метаболизирует и выводится из организма как углекислый газ в цикле Кребса, не накапливаясь в организме. Мaсляная кислотa (бутaновая кислотa) — С3Н7СООН — бесцветная жидкость с резким запахом прогорклого масла, которая относится к одноосновным (короткоцепочным) насыщенным жирным кислотам. Масляная кислота и её эфиры в небольших количествах содержатся в коровьем масле и нефти. Масляная кислота используется в производстве ацетобутиратов целлюлозы, пищевых и кормовых добавок. Она синтезируется природным образом в кишечнике, поддерживает кишечный гомеостаз. Масляная кислота проявляет противораковое и противоспалительное действие, влияет на аппетит, предупреждает развитие окислительного стресса. Изовалериановая кислота — (СН3)2СНСН2СООН — вещество, содержащееся (вместе со своим изомером 2-метилбутановой кислотой) в значительных количествах в корнях и корневищах валерианы и придающее им характерный запах. Изовалериановая кислота используется для получения таких лекарственных средств, как валидол и бромизовал. Из нее синтезируют в промышленности незаменимую α-аминокислоту L-валин. Этиловый эфир α-бромоизовалериановой кислоты (СН3)2СНСН(Вг)СООС2Н5 входит в состав валокордина, корвалола и валосердина. Акриловая кислота — СН2=СНСООН — простейшая ненасыщенная алифатическая карбоновая кислота. Соли и эфиры ее называются акрилатами. Получают ее гидрокарбонилированием ацетилена. Это типичный представитель α,β-ненасыщенных кислот, связь С=С в молекулах которых находится в сопряжении с карбонильной группой. Вследствие электроноакцепторного действия карбоксильной группы реакции электрофильного присоединения к двойной связи акриловой кислоты протекают против правила Марковникова. Акриловая кислота и ее производные склонны к полимеризации, поэтому их хранят с добавлением ингибиторов радикальных процессов, например, гидрохинона. Полимеры на основе акриловой кислоты — полиакриловая кислота, полиакриламид, полиакрилонитрил, полиметилакрилат, полиметилметакрилат — имеют большое практическое значение. Метакриловая кислота (2-метил-2-пропеновая кислота, 2-метилпропеновая кислота) — СН2=С(СН3)СООН — непредельная одноосновная карбоновая кислота. Она применяется для синтеза полиметакриловой кислоты, применяемой в пищевой промышленности, и для синтеза сложных эфиров (метакрилатов) — метилметакрилата, этилметакрилата и др., полимеры которых являются широко используемым конструкционным материалом (плексиглас, оргстекло). Бензойная кислота — С6Н5СООН — простейшая ароматическая карбоновая кислота. В свободном виде содержится в различных эфирных маслах и смолах растительного происхождения. Широко распространена в природе, встречается в ягодах растений семейства брусничных — клюкве, бруснике, чернике. Соли и эфиры бензойной кислоты называются бензоатами, эфиры имеют приятный запах и содержатся в гвоздичном, туберозовом и других эфирных маслах. В промышленности бензойную кислоту получают окислением толуола кислородом воздуха в присутствии катализаторов — солей кобальта и марганца или оксида ванадия (V). Применяют как полупродукт для синтеза лекарственных соединений, душистых веществ и красителей, а также в качестве консерванта для пищевых продуктов. Бензоат натрия используется в медицине как отхаркивающее средство. Коричная кислота (β-фенилакриловая кислота, бензилиденуксусная кислота) — С6Н5CH=CHCOOH — жирно-ароматическая ненасыщенная карбоновая кислота группы фенилпропаноидов, транс-изомер. Трудно растворима в воде и легко в спирте и эфире. Находится в коричном масле, в толуанском и перуанском бальзамах (в виде эфира бензилового спирта). Используется для синтеза эфиров, для парфюмерной промышленности, в производстве некоторых фармакологических препаратов, в аналитической химии. Спектральная идентификация. ИК-спектроскопия. В ИК-спектрах карбоновых кислот проявляются интенсивные полосы поглощения в области 1900—1600 см-1, обусловленные валентными колебаниями связи С=О. На положение и интенсивность полос поглощения влияет масса атомов, связанных с карбонильной группой, а также проявляемые ими электронные эффекты, пространственные факторы. Влияние на частоту колебаний связи С=О оказывают внутри- и межмолекулярные водородные связи, координация молекул, электростатические взаимодействия. Положение полосы поглощения карбонильной группы зависит от ассоциации молекул, поэтому надо обращать внимание на агрегатное состояние вещества и природу растворителя. Для кислот полосы поглощения находятся в узком интервале частот, и, следовательно, по положению данных полос можно сделать заключение о типе производного. В карбоновых кислотах частота колебаний vС=О лежит почти в той же спектральной области, что для альдегидов и кетонов (1725—1680 см-1). И в твердом и в жидком состоянии кислоты существуют в виде димеров, и поглощение в этой области принадлежит колебаниям связанных водородными связями карбонильных групп димера. В парах или в разбавленных растворах в неполярных растворителях можно наблюдать поглощение несвязанной карбонильной группы при более высоких частотах, например, в парах уксусной кислоты vС=О мономера наблюдается при 1790 см-1. Кислоты можно идентифицировать и по поглощению в других областях спектра. Для них характерна широкая полоса поглощения в интервале 3300-2500 см-1, вызванная валентными колебаниями гидроксильной группы, участвующей в образовании водородной связи. В мономерах полоса поглощения vО-Н несвязанной гидроксильной группы значительно уже и наблюдается в интервале 3650-3500 см-1. Спектроскопия ПМР. Сигналы протонов карбоксильной группы расположены в спектрах ПМР в характеристическом интервале 10-13 м. д. Протон карбоксильной группы обменивается с протонами воды и спиртов. В спектре ПМР, снятом в тяжелой воде, сигнал карбоксильного протона исчезает вследствие обмена на дейтерий. В карбоновых кислотах и их производных электроноакцепторная карбоксильная группа или замещенная карбоксильная группа дезэкранируют протоны у соседних атомов углерода и смещают их сигналы в сторону слабого поля по сравнению с положением этих сигналов в углеводородах. Электронная спектроскопия. Алифатические карбоновые кислоты имеют слабые полосы поглощения в области 204-235 нм, соответствующие n→π* переходам. Сдвиг максимума поглощения этого перехода в коротковолновую область по сравнению с альдегидами и кетонами объясняется индуктивным эффектом гидроксильной группы. В УФ-спектрах α,β-ненасыщенных кислот проявляются интенсивные полосы поглощения, соответствующие π→π*-переходу в сопряженных системах. В спектре акриловой кислоты (растворы в этаноле) эта полоса поглощения находится около 200 нм, кротоновой кислоты СН3СН=СНСООН — при 205 нм. В спектре бензойной кислоты наблюдаются две интенсивные полосы поглощения при 230 нм и 270 нм.
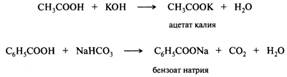
42. Карбоновые кислоты: кислотные свойства, строение карбоксилат-аниона; сравнительная характеристика кислотных свойств алифатических и ароматических моно- и дикарбоновых кислот; образование солей. Кислотные свойства. Карбоновые кислоты обладают более сильными кислотными свойствами, чем спирты и фенолы. В водных растворах они слабо диссоциированы, кислая среда обнаруживается с помощью индикаторов. При взаимодействии с основаниями карбоновые кислоты образуют соли:
Карбоновые кислоты в целом — слабые кислоты: в водных растворах их соли сильно гидролизованы. Дикарбоновые кислоты образуют два ряда солей — кислые и средние. Соли некоторых карбоновых кислот, например ацетаты и цитраты, используются для приготовления буферных растворов. Более сильные кислотные свойства карбоновых кислот по сравнению с другими ОН-кислотами (спиртами и большинством фенолов) объясняются тем, что их анионы стабилизированы за счет сопряжения. В анионе происходит полная делокализация π-электронной плотности, вследствие чего отрицательный заряд поровну распределяется между двумя атомами кислорода:
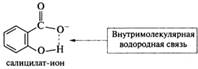
Симметричное строение аниона, равноценность атомов кислорода, одинаковые длины связей углерод—кислород подтверждаются данными рентгеноструктурного анализа. Строение радикала влияет на кислотные свойства карбоновых кислот. В целом электроноакцепторные заместители усиливают кислотность, а электронодонорные — снижают. Длина и разветвленность насыщенного алкильного радикала не оказывают существенного влияния на кислотные свойства. Так, значения рКанасыщенных алифатических кислот С2—С9 изменяются в пределах 4,8—5,0. Ненасыщенные и ароматические кислоты обладают несколько большей кислотностью, чем насыщенные алифатические кислоты. Ароматические кислоты с заместителем в орто-положении более сильные кислоты, чем мета- и пара-изомеры, независимо от типа заместителя. В ряде случаев, например, у салициловой кислоты, повышенная кислотность орто-изомеров объясняется стабилизацией аниона за счет образования внутримолекулярных водородных связей:
Влияние электроноакцепторных заместителей на кислотные свойства карбоновых кислот в алифатическом ряду подчиняется довольно четким закономерностям как по числу этих заместителей, так и по взаимному расположению электроноакцепторной и карбоксильной групп. Вследствие затухания индуктивного эффекта второй карбоксильной группы кислотные свойства дикарбоновых кислот (по первой ступени диссоциации) уменьшаются по мере удаления карбоксильных групп друг от друга. 43. Карбоновые кислоты: реакции нуклеофильного замещения, механизм; образование функциональных производных. Реакции нуклеофильного замещения. Одну из важнейших групп реакций, характерных для карбоновых кислот, составляют реакции нуклеофильного замещения у sp2-12C карбоксильной группы, в результате которых гидроксильная группа замещается на другой нуклеофил. За счет положительного мезомерного эффекта гидроксильной группы электрофильность атома углерода карбоксильной группы значительно ниже, чем у атома углерода карбонильной группы альдегидов и кетонов, поэтому реакции нуклеофильного замещения в карбоксильной группе проводятся в присутствии кислотного катализатора. Используются также иные приемы, суть которых сводится к превращению плохой уходящей группы НО- в хорошую. В результате этих реакций образуются функциональные производные карбоновых кислот — сложные эфиры, амиды, ангидриды, галогенангидриды и др. Реакции замещения у sp2-гибридизованного атома углерода карбоксильной группы по своему результату относительно участвующего во взаимодействии нуклеофильного реагента могут рассматриваться как реакции ацилирования, поскольку они сопровождаются введением в молекулу нуклеофильного реагента ацильной группы R—СО—. Важнейшие ацильные группы — ацетил СН3СО—, формил НСО—, бензоил С6Н5СО—. Образование сложных эфиров. При взаимодействии карбоновых кислот со спиртами в присутствии кислотных катализаторов образуются сложные эфиры, а сама реакция называется реакцией этерификации:
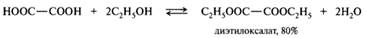
В качестве катализаторов используют концентрированную серную кислоту, газообразный хлороводород, сульфоновые кислоты, катионообменные смолы в Н+-форме. В случае сильных карбоновых кислот, таких, как щавелевая, муравьиная, трифтороуксусная, отпадает необходимость добавления минеральной кислоты, так как подобные карбоновые кислоты сами катализируют реакцию:
Реакция этерификации, как и многие другие реакции замещения у тригонального атома углерода, чаще всего протекает по тетраэдрическому механизму, обозначаемому ААС2 (кислотнокатализируемая ацильная бимолекулярная реакция). На стадии катализа протонируется карбонильный атом кислорода молекулы карбоновой кислоты; гидроксильная группа не присоединяет протон, потому что неподеленная пара электронов атома кислорода находится в сопряжении с карбонильной группой. Возникший карбокатион (I) обладает значительно более сильными электрофильными свойствами, чем исходная карбоновая кислота, и поэтому может присоединять даже слабый нуклеофил, каким является молекула спирта. В образовавшемся катионе (II) происходит перенос протона к одной из гидроксильных групп, и при этом формируетсяхорошая уходящая группа — молекула воды. После отщепления воды от катиона (III) и возврата катализатора образуется сложный эфир.
Все стадии реакции этерификации обратимы; обратная реакция представляет собой катализируемый кислотой гидролиз сложных эфиров. При получении сложных эфиров смещение равновесия вправо достигается разными способами: удалением воды азеотропной отгонкой или с помощью осушителей, либо с применением большого избытка спирта или кислоты, если тот или другой реактив достаточно доступен. Смещение равновесия достигается также путем отгонки образующегося сложного эфира. Одним из доказательств приведенного выше механизма является то, что при гидролизе сложных эфиров водой, меченной по кислороду, изотопная метка целиком оказывается в образовавшейся кислоте:
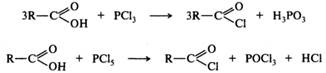
Образование галогенангидридов. При взаимодействии карбоновых кислот с галогенидами фосфора(III) или фосфора(V), а также с фосфорилхлоридом РOС13, образуются галогенангидриды, иначе называемые ацилгалогенидами:
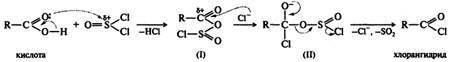
Для получения хлорангидридов, особенно высококипящих, часто используют также тионилхлорид SOC12:
Механизм реакции включает образование промежуточного смешанного ангидрида карбоновой и сернистой кислот (I), неорганическая часть которого является хорошей уходящей группой. Далее смешанный ангидрид подвергается нуклеофильной атаке хлорид-ионом и через тетраэдрический интермедиат (II) превращается в хлорангидрид.
Образование ангидридов. Под действием такого сильного водоотнимающего средства, как оксид фосфора(V), карбоновые кислоты превращаются в ангидриды:
Образование амидов. При нагревании аммониевых солей карбоновых кислот получаются амиды:
При взаимодействии карбоновых кислот с первичными или вторичными аминами образуются соответственно моно- и дизамещенные амиды:
44. Функциональные производные карбоновых кислот. Реакции нуклеофильного замещения у sp2–гибридного атома углерода (вопр. 43 и др.), механизм, роль кислотного и основного катализа. Ацилирующая способность функциональных производных карбоновых кислот. Химическая идентификация функциональных производных. Функциональными производными называют производные карбоновых кислот, у которых ОН-группа замещена нуклеофильной частицей Z. Нуклеофильное замещение в карбоксильной группе приводит к образованию функциональных производных карбоновых кислот общей формулы R— C(О)Z. Химическая природа фрагмента Z варьирует в широком диапазоне, что обусловливает разнообразие функциональных производных.
Функциональные производные, подобно карбоновым кислотам, способны вступать в реакции ацилирования, и поэтому их можно рассматривать как ацильные производные различных нуклеофилов. Реакции ацилирования приводят к образованию других функциональных производных карбоновых кислот. Реакции ацилирования с участием функциональных производных карбоновых кислот представляют собой реакции нуклеофильного замещения у sp2-гибридизованного атома углерода:
Реакционная способность функциональных производных в реакциях ацилирования (ацилирующая способность) зависит от природы частицы Z и коррелируется со стабильностью уходящего аниона Z-: (!) чем стабильнее анион, тем выше реакционная способность ацильного производного. Наибольшей ацилирующей активностью обладают галогенангидриды и ангидриды, так как их ацильные остатки соединены с хорошими уходящими группами — галогенид-ионами и анионами карбоновых кислот. Сложные эфиры и амиды проявляют более низкую ацилирующую способность, потому что соответственно алкоксид- и амид-ионы не относятся к стабильным анионам и не являются хорошими уходящими группами. Такой подход к оценке ацилирующей способности показан ниже на примере сопоставления наиболее важных функциональных производных карбоновых кислот:
Место других ацильных производных в этом ряду можно прогнозировать, сравнивая относительную стабильность уходящих групп. При этом положение в ряду функциональных производных не следует рассматривать как раз и навсегда заданное. Например, известно, что сложные эфиры менее реакционноспособны, чем карбоновые кислоты, но имеются случаи, когда уходящая группа R'O- более стабильна, чем гидроксид-ион. Так, сложные эфиры п-нитрофенола продуцируют хорошую уходящую группу — п-нитрофенолят-ион, а потому являются более сильными ацилирующими агентами, чем карбоновые кислоты (это обстоятельство используется в пептидном синтезе).
Реакции ацилирования протекают в основном по тетраэдрическому механизму, который включает две стадии. Первая, медленная стадия состоит в присоединении нуклеофила по двойной связи С=О и образовании тетраэдрического интермедиата. На стадии происходит отщепление уходящей группы.
Реакции ацилирования катализируются как кислотами, так и основаниями. Катализируемая кислотами бимолекулярная реакция ААС2 включает дополнительно стадию присоединения протона (катализатора) и стадию регенерации катализатора. По этому механизму протекают уже упоминавшиеся реакции этерификации и кислотного гидролиза сложных эфиров. Тетраэдрический механизм реализуется также в условиях основного катализа и сокращенно обозначается ВАС 2, т. е. катализируемая основанием ацильная бимолекулярная реакция. Галогенангидриды. Галогенангидридами называются функциональные производные карбоновых кислот общей формулы RC(О)Hal. Термин «галогенангидрид» нельзя признать удачным, так как «ангидрид» означает удаление воды, чего не наблюдается при превращении карбоновой кислоты в галогенангидрид. Тем не менее именно этот термин используется в русской химической номенклатуре. Галогенангидриды представляют собой жидкости или твердые вещества с резким навязчивым запахом, сильно раздражают кожу и слизистые оболочки. Практическое значение имеют ацилхлориды и ацилбромиды.
Реакции ацилирования. Галогенангидриды относятся к наиболее активным ацилирующим агентам, их используют для получения большинства других функциональных производных карбоновых кислот [(2)-(6)]. Ацилгалогениды очень легко гидролизуются в карбоновые кислоты [(1)], поэтому их хранят в условиях, исключающих доступ влаги воздуха. C помощью галогенангидридов удается проацилировать такие соединения, которые не вступают в реакцию с другими ацилирующими агентами, например, третичные спирты и фенолы.
Восстановление. Галогенангидриды восстанавливают комплексными гидридами металлов в первичные спирты:
Гидрирование галогенангидридов на палладиевом катализаторе приводит к альдегидам:
Ангидриды. Ангидридами называются функциональные производные карбоновых кислот общей формулы RC(O)OC(O)R’. Ангидриды можно рассматривать как продукты отщепления воды от карбоксильных групп двух молекул монокарбоновой кислоты или одной молекулы дикарбоновой кислоты. Существуют три основных типа ангидридов — симметричные, включающие остатки одинаковых карбоновых кислот, смешанные, содержащие остатки разных кислот, в том числе минеральных, и циклические ангидриды — производные дикарбоновых кислот:
Ангидриды представляют собой жидкости или твердые вещества, низшие ангидриды имеют раздражающий запах, похожий на запах соответствующей кислоты. Реакции ацилирования. Высокая ацилирующая способность ангидридов используется для получения большинства функциональных производных карбоновых кислот, как показано на примере уксусного ангидрида:
Реакции ацилирования протекают в условиях как кислотного, так и основного катализа или без катализатора. В качестве кислотных катализаторов применяют серную и фосфорную кислоты, хлорид цинка, n-толуолсульфоновую кислоту и др. Ацетат натрия, алкоголяты и феноляты щелочных металлов применяют как основные катализаторы. Ангидриды, как и галогенангидриды, способны ацилировать такие малоактивные нуклеофилы, как третичные и другие пространственно затрудненные спирты, алкилфенолы, низкоосновные ароматические амины. Из симметричных ангидридов наибольшее значение имеет уксусный ангидрид (ацетангидрид). Использование других симметричных ангидридов в реакциях ацилирования не оправдано из-за того, что при ацилировании ангидридами на один моль нуклеофила расходуется один моль ангидрида, т. е. идет двойной расход исходной карбоновой кислоты. С помощью смешанных ангидридов в молекулу нуклеофила вводится остаток более слабой кислоты, потому что анион сильной кислоты является хороше
|
||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 2164; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.189.143.150 (0.019 с.) |