
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Окислительно-восстановительных реакцийСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
(метод электронно-ионного баланса) 1. Записать уравнение реакции, определить степень окисления каждого элемента и найти элементы, которые в результате реакции изменяют степень окисления, выделить окислитель и восстановитель. 2. Составить полуреакции окисления и восстановления с учетом правил написания ионных уравнений: слабые электролиты, неэлект-ролиты, труднорастворимые соединения записываются в молеку-лярном виде, а сильные электролиты – в ионном. 3. Уравнять число атомов каждого элемента в левой и правой частях полуреакций. При этом в водных растворах в реакциях могут участвовать молекулы воды, ионы водорода или гидроксида. Уравнивание кислорода происходит по-разному в кислой, нейтральной и щелочной средах. В кислой среде в ту часть уравнения, где недостаток кислорода, следует приписать столько молекул H2O, каков недостаток кислорода, а в противоположную часть полуреакции – соответству-ющее число ионов водорода. В щелочной среде в ту часть уравнения, где кислород в недостатке, следует записать вдвое больше ионов гидроксида, чем не хватает кислорода, а в противоположную часть полуреакции – соответствующее число молекул Н2О. В нейтральной среде прием уравнивания зависит от продуктов реакции. 4. Суммарное число зарядов в обеих частях каждой полуреакции должно быть одинаковым. Это достигается путем добавления к левой части или отнятия от левой части полуреакции необходимого числа электронов. 5. Составить электронный баланс, т.е. соблюдая равенство числа отдаваемых и принимаемых электронов, найти для каждой полуреакции наименьший множитель, который одновременно является определяемым коэффициентом. 6. Сложить уравнения полуреакций с учетом найденных коэффициентов и сократить, если необходимо, в обеих частях результирующего уравнения одинаковые частицы. Коэффициенты перенести в уравнение химической реакции. 7. Определить недостающие коэффициенты в уравнении реакции, последовательно уравнивая число атомов металлов, затем неметаллов и водорода. 8. Проверить правильность расстановки коэффициентов в уравнении реакции по числу атомов кислорода в левой и правой частях уравнения.
Пример 3. Уравнять методом полуреакций окислительно-восстановительную реакцию: FeSO4 + KMnO4 + H2SO4 Решение.
FeSO4 + KMnO4 + H2SO4 Видно, что в ходе реакции степень окисления железа повышается от +2 до +3 (процесс окисления), а марганца, входящего в кислотный остаток, – понижается от +7 до +2 (процесс восстановления). Таким образом: 2Fe2+ - 2ē Для составления уравнения полуреакции восстановления используется схема: MnO4- В правой части не хватает четырех атомов кислорода, следовательно, в правую часть следует прибавить четыре молекулы воды, а в левую часть – восемь ионов Н MnO4- + 8H+ Суммарный заряд левой части равен +7, заряд правой части +2. Чтобы заряд левой части был равен заряду правой части, необходимо прибавить к левой части пять электронов: MnO4- + 8H+ + 5ē Отношение числа электронов, отданных при окислении железа и принятых при восстановлении марганца, составляет 2:5, следова-тельно, складывая уравнения двух полуреакций, необходимо первое умножить на 5, а второе на 2:
В молекулярной форме уравнение имеет следующий вид: 10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O. Пример 4. Уравнять методом полуреакций следующую окислительно-восстановительную реакцию: NaCrO2 + Br2 + NaOH
NaCrO2 + Br2 + NaOH В ходе реакции степень окисления хрома, находящегося в кислотном остатке, повышается от +3 до +6 (процесс окисления), а брома понижается от 0 до −1 (процесс восстановления). Таким образом: Вr2 + 2ē Для составления уравнения полуреакции окисления используется схема: CrO2- В левой части не хватает двух атомов кислорода, следовательно, в левую часть следует прибавить четыре иона ОН– (вдвое больше, чем не хватает кислорода), в правую часть – две молекулы воды: CrO2- + 4ОН- Суммарный заряд левой части равен –5, заряд правой части равен –2. Чтобы заряд левой части был равен заряду правой части, необходимо из левой части вычесть три электрона: CrO2- + 4ОН- – 3ē Поскольку отношение чисел электронов, отданных при окислении и принятых при восстановлении, равно 3:2, то, складывая уравнения двух полуреакций, первое следует умножить на 2, а второе – на 3:
В молекулярной форме уравнение имеет следующий вид: 2KCrO2 + 3Br2 + 8KOH = 2K2CrO4 + 6KBr + 4H2O. Оксидиметрия Многие химические процессы в живой природе носят окислительно-восстановительный характер. Для количественного определения окислителей и восстановителей используют методы окислительно-восстановительного титрования или оксидиметрии. Так, в клинических и биологических исследованиях оксиди-метрически определяют содержание ферментов каталазы и пероксидазы, аскорбиновой кислоты, сахара в крови, мочевой кислоты в моче и т. д. В санитарно-гигиенических исследованиях при помощи оксидиметрии определяют содержание активного хлора в питьевой воде, растворенного кислорода и органических примесей в воде природных водоемов и т. д. В зависимости от применяемых титрантов оксидиметрию разделяют на перманганатометрию (титрант – перманганат калия), йодометрию (титранты – йод и тиосульфат натрия), йодатометрию (титрант – йодат калия), нитритометрию (титрант – нитрит натрия), цериметрию (титрант – сульфат церия IV), дихроматометрию (титрант – дихромат калия). Особенно широко в медицине и биологии применяют перманганатометрию и йодометрию. Перманганатометрия Данный метод основан на окислительной активности перманганата калия КМnО4. В ходе прямого перманганатометричес-кого титрования КМnО4, восстанавливаясь, окисляет многие восстановители. Характер восстановления перманганат-иона зависит от среды:
Перманганатометрическое титрование почти всегда проводят в кислой среде. Такой выбор обусловлен двумя причинами: во-первых, в кислой среде окислительная активность перманганата калия максимальна; во-вторых, образующиеся в результате реакции ионы Mn2+ бесцветны и, таким образом, заметно отличаются от ионов MnO4–, окрашенных в фиолетовый цвет. Последнее свойство позволяет использовать перманганат-ион не только в качестве реагента, но и в качестве индикатора. Действительно, первая избыточная (после достижения точки эквивалентности) капля титранта окрашивает титруемый раствор в розовый цвет, что и является сигналом для прекращения титрования. В то же время этим методом можно определять и окислители, добавляя к ним известный избыток раствора восстановителя, например оксалата натрия Na2C2O4 или сульфата железа (II) FeSO4, а затем титруя не вступивший в реакцию остаток (обратное перманганатометрическое титрование). Иодометрия Иодометрия основана на реакциях: 2I- – 2ē I2 + 2ē Стандартный окислительно-восстановительный потенциал системы I2/2I- ( 1. Определение восстановителей. При определении сильных восстановителей (сульфидов, сульфитов, тиосульфатов) титрантом является желто-коричневый раствор иода, который в результате реакции I2 + 2ē Na2SO3 + I2 + H2O = Na2SO4 + 2HI H2S + I2 = 2HI + S
2. Определение окислителей Иодометрию можно использовать и для определения концентраций окислителей, таких как перманганаты, хроматы, дихроматы, хлор и бром в свободном состоянии и др. В данном случае используется реакция 2I– – 2 K2Cr2O7 + 6KI + 7H2SO4 = 3I2 + Cr2(SO4)3 + 4K2SO4 + 7H2O I2 + 2Na2S2O3 = Na2S4O6 + 2NaI
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 782; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.84.128 (0.009 с.) |

 Fe2(SO4)3 + MnSO4 + K2SO4 + H2O.
Fe2(SO4)3 + MnSO4 + K2SO4 + H2O. :
: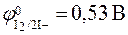 ) занимает промежуточное положение между потенциалами сильных окислителей и сильных восстанови-телей. Поэтому метод иодометрии применяется при определении как окислителей, так и восстановителей.
) занимает промежуточное положение между потенциалами сильных окислителей и сильных восстанови-телей. Поэтому метод иодометрии применяется при определении как окислителей, так и восстановителей.



