
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Сильные и слабые электролитыСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Сильные и слабые электролиты Количественной характеристикой процесса электролитической диссоциации является степень диссоциации. Степенью диссоциации a называется отношение количества электролита, распавшегося на ионы (n), к общему количеству электролита (n0):
Величина a выражается в долях единицы или в % и зависит от природы электролита, растворителя, температуры, концентрации и состава раствора. Особую роль играет растворитель: в ряде случаев при переходе от водных растворов к органическим растворителям степень диссоциации электролитов может резко возрасти или уменьшиться. В дальнейшем, при отсутствии специальных указаний, будем считать, что растворителем является вода. По степени диссоциации электролиты условно разделяют на сильные (a > 30%), средние (3% < a < 30%) и слабые (a < 3%). К сильным электролитам относят: 1) некоторые неорганические кислоты (HCl, HBr, HI, HNO3, H2SO4, HClO4 и ряд других); 2) гидроксиды щелочных (Li, Na, K, Rb, Cs) и щелочноземельных (Ca, Sr, Ba) металлов; 3) почти все растворимые соли. Принято считать, что эти соединения диссоциируют полностью, т.е., на 100%. К электролитам средней силы относят Mg(OH)2, H3PO4, HCOOH, H2SO3, HF и некоторые другие. Слабыми электролитами считают все карбоновые кислоты (кроме HCOOH) и гидратированные формы алифатических и ароматических аминов. Слабыми электролитами являются также многие неоргани-ческие кислоты (HCN, H2S, H2CO3 и др.) и основания (NH3∙H2O). Несмотря на некоторые совпадения, в целом не следует отождествлять растворимость вещества с его степенью диссоциации. Так, уксусная кислота и этиловый спирт неограниченно растворимы в воде, но в то же время первое вещество является слабым электро-литом, а второе - неэлектролит. Кислоты и основания Несмотря на то, что понятия «кислота» и «основание» широко используются для описания химических процессов, единого подхода к классификации веществ с точки зрения отнесения их к кислотам или основаниям нет. Существующие в настоящее время теории (ионная теория С. Аррениуса, протолитическая теория И. Бренстеда и Т. Лоури и электронная теория Г. Льюиса) имеют определенные ограничения и, таким образом, применимы лишь в частных случаях. Остановимся подробнее на каждой из этих теорий. Теория Аррениуса. В ионной теории Аррениуса понятия «кислота» и «основание» тесно связаны с процессом электролитической диссоциации: Кислотой является электролит, диссоциирующий в растворах с образованием ионов Н+; Основанием является электролит, диссоциирующий в растворах с образованием ионов ОН-; Амфолитом (амфотерным электролитом) является электролит, диссоциирующий в растворах с образованием как ионов Н+, так и ионов ОН-. Например:
В соответствии с ионной теорией кислотами могут быть как нейтральные молекулы, так и ионы, например: HF ⇄ H+ + F- H2PO4- ⇄ H+ + HPO42- NH4+ ⇄ H+ + NH3 Аналогичные примеры можно привести и для оснований: КОН [Al(OH)4]- ⇄ Al(OH)3 + ОН- [Fe(OH)]+ ⇄ Fe2+ + ОН- К амфолитам относят гидроксиды цинка, алюминия, хрома и некоторые другие, а также аминокислоты, белки, нуклеиновые кислоты. В целом, кислотно-основное взаимодействие в растворе сводится к реакции нейтрализации: H+ + ОН- Однако, ряд экспериментальных данных показывает ограниченность ионной теории. Так, аммиак, органические амины, оксиды металлов типа Na2O, СаО, анионы слабых кислот и т.д. в отсутствии воды проявляют свойства типичных оснований, хотя не имеют в своем составе гидроксид-ионов. С другой стороны, многие оксиды (SO2, SO3, Р2О5 и т.д.), галогениды, галогенангидриды кислот, не имея в своем составе ионов водорода, даже в отсутствии воды проявляют кислотные свойства, т.е. нейтрализуют основания. Кроме того, поведение электролита в водном растворе и в неводной среде может быть противоположным. Так, CH3COOH в воде является слабой кислотой: CH3COOH ⇄ CH3COO- + H+, а в жидком фтороводороде проявляет свойства основания: HF + CH3COOH ⇄ CH3COOH2+ + F- Исследования подобных типов реакций и в особенности реакций, протекающих в неводных растворителях, привели к созданию более общих теорий кислот и оснований. Теория Бренстеда и Лоури. Дальнейшим развитием теории кислот и оснований явилась предложенная И. Бренстедом и Т. Лоури протолитическая (протонная) теория. В соответствии с этой теорией: Кислотой называют любое вещество, молекулы (или ионы) которого способны отдавать протон, т.е. быть донором протона; Основанием называют любое вещество, молекулы (или ионы) которого способны присоединять протон, т.е. быть акцептором протона; Таким образом, понятие основания значительно расширяется, что подтверждается следующими реакциями: ОН- + Н+ NH3 + H+ H2N-NH3+ + H+ По теории И. Бренстеда и Т. Лоури кислота и основание составляют сопряженную пару и связаны равновесием: КИСЛОТА ⇄ ПРОТОН + ОСНОВАНИЕ Поскольку реакция переноса протона (протолитическая реакция) обратима, причем в обратном процессе тоже передается протон, то продукты реакции являются друг по отношению к другу кислотой и основанием. Это можно записать в виде равновесного процесса: НА + В ⇄ ВН+ + А-, где НА – кислота, В – основание, ВН+ – кислота, сопряженная с основанием В, А- – основание, сопряженное с кислотой НА. Примеры. 1) в реакции: HCl + OH- ⇄ Cl- + H2O, HCl и H2O – кислоты, Cl- и OH- – соответствующие сопряженные с ними основания; 2) в реакции: HSO4- + H2O ⇄ SO42- + H3O+, HSO4- и H3O+ – кислоты, SO42- и H2O – основания; 3) в реакции: NH4+ + NH2- ⇄ 2NH3, NH4+ – кислота, NH2- – основание, а NH3 выступает в роли как кислоты (одна молекула), так и основания (другая молекула), т.е. демонстрирует признаки амфотерности – способности проявлять свойства кислоты и основания. Такой способностью обладает и вода: 2Н2О ⇄ Н3О+ + ОН- Здесь одна молекула Н2О присоединяет протон (основание), образуя сопряженную кислоту – ион гидроксония Н3О+, другая отдает протон (кислота), образуя сопряженное основание ОН-. Этот процесс называется автопротолизом. Из приведенных примеров видно, что в отличие от представлений Аррениуса, в теории Бренстеда и Лоури реакции кислот с основаниями не приводят к взаимной нейтрализации, а сопровождаются образованием новых кислот и оснований. Необходимо также отметить, что протолитическая теория рассматривает понятия «кислота» и «основание» не как свойство, но как функцию, которую выполняет рассматриваемое соединение в протолитической реакции. Одно и то же соединение может в одних условиях реагировать как кислота, в других – как основание. Так, в водном растворе СН3СООН проявляет свойства кислоты, а в 100%-й H2SO4 – основания. Однако, несмотря на свои достоинства, протолитическая теория, как и теория Аррениуса, не применима к веществам, не содержащим атомов водорода, но, в тоже время, проявляющим функцию кислоты: галогенидам бора, алюминия, кремния, олова. Теория Льюиса. Иным подходом к классификации веществ с точки зрения отнесения их к кислотам и основаниям явилась электронная теория Льюиса. В рамках электронной теории: кислотой называют частицу (молекулу или ион), способную присоединять электронную пару (акцептор электронов); основанием называют частицу (молекулу или ион), способную отдавать электронную пару (донор электронов). Согласно представлениям Льюиса, кислота и основание взаимодействуют друг с другом с образованием донорно-акцепторной связи. В результате присоединения пары электронов у атома с электронным дефицитом возникает завершенная электронная конфигурация - октет электронов. Например:
Аналогичным образом можно представить и реакцию между нейтральными молекулами:
Реакция нейтрализации в терминах теории Льюиса рассматривается как присоединение электронной пары гидроксид-иона к иону водорода, предоставляющему для размещения этой пары свободную орбиталь:
Таким образом, сам протон, легко присоединяющий электронную пару, с точки зрения теории Льюиса, выполняет функцию кислоты. В этой связи, кислоты по Бренстеду могут рассматриваться как продукты реакции между льюисовскими кислотами и основаниями. Так, HCl является продуктом нейтрализации кислоты H+ основанием Cl-, а ион H3O+ образуется в результате нейтрализации кислоты H+ основанием H2O. Реакции между кислотами и основаниями Льюиса также иллюстрируют следующие примеры:
К основаниям Льюиса также относят галогенид-ионы, аммиак, алифатические и ароматические амины, кислородсодержащие органические соединения типа R2CO, (где R - органический радикал). К кислотам Льюиса относят галогениды бора, алюминия, кремния, олова и других элементов. Очевидно, что в теории Льюиса понятие «кислота» включает в себя более широкий круг химических соединений. Это объясняется тем, что по Льюису отнесение вещества к классу кислот обусловлено исключительно строением его молекулы, определяющим электронно-акцепторные свойства, и не обязательно связано с наличием атомов водорода. Льюисовские кислоты, не содержащие атомов водорода, называют апротонными. Эталоны решения задач 1. Написать уравнение электролитической диссоциации Al2(SO4)3 в воде. Ответ. Сульфат алюминия является сильным электролитом и в водном растворе подвергается полному распаду на ионы. Уравнение диссоциации:
или (без учета процесса гидратации ионов):
2. Чем является ион HCO3- с позиций теории Бренстеда-Лоури? Ответ. В зависимости от условий ион HCO3– может как отдавать протоны:
так и присоединять протоны:
Таким образом, в первом случае ион HCO3- является кислотой, во втором - основанием, т. е. является амфолитом. 3. Определить, чем с позиций теории Льюиса является ион Ag+ в реакции:
Ответ. В процессе образования химических связей, который протекает по донорно-акцепторному механизму, ион Ag+, имея свободную орбиталь, является акцептором электронных пар, и, таким образом, проявляет свойства кислоты Льюиса. 4. Определить ионную силу раствора в одном литре которого находятся 0,1 моль KCl и 0,1 моль Na2SO4. Решение. Диссоциация представленных электролитов протекает в соответствии с уравнениями:
Отсюда: С(K+) = С(Cl-) = С(KCl) = 0,1 моль/л; С(Na+) = 2×С(Na2SO4) = 0,2 моль/л; С(SO42-) = С(Na2SO4) = 0,1 моль/л. Ионную силу раствора вычисляем по формуле:
5. Определить концентрацию CuSO4 в растворе данного электролита с I = 0,6 моль/л. Решение. Диссоциация CuSO4 протекает по уравнению:
Примем С(CuSO4) за x моль/л, тогда, в соответствии с уравнением реакции, С(Cu2+) = С(SO42-) = x моль/л. В данном случае выражение для расчета ионной силы будет иметь вид:
Отсюда:
6. Определить коэффициент активности иона K+ в водном растворе KCl с С(KCl) = 0,001 моль/л. Решение. Коэффициент активности можно рассчитать, используя предельный закон Дебая-Хюккеля:
который в данном случае примет вид:
Ионную силу раствора найдем по формуле:
7. Определить коэффициент активности иона Fe2+ в водном растворе, ионная сила которого равна 1. Решение. В соответствии с законом Дебая-Хюккеля:
следовательно:
8. Определить константу диссоциации кислоты HA, если в растворе этой кислоты с концентрацией 0,1 моль/л a = 24%. Решение. По величине степени диссоциации можно определить, что данная кислота является электролитом средней силы. Следовательно, для расчета константы диссоциации кислоты используем закон разведения Оствальда в его полной форме:
9. Определить концентрацию электролита, если a = 10%, K д = 10-4. Решение. Из закона разведения Оствальда:
находим:
10. Степень диссоциации одноосновной кислоты HA не превышает 1%. Решение. По величине степени диссоциации можно определить, что данная кислота является слабым электролитом. Это позволяет использовать приближенную формулу закона разведения Оствальда:
11. Степень диссоциации электролита в его растворе с кон-центрацией 0,001 моль/л равна 0,009. Определить константу диссоциации этого электролита. Решение. Из условия задачи видно, что данный электролит является слабым (a = 0,9%). Поэтому:
12. Решение. Рассчитаем
Отсюда:
Так как
13. Имеются два раствора KCl, содержащие при этом и другие ионы. Известно, что ионная сила первого раствора (I 1) равна 1, а второго (I 2) составляет величину 10-2. Сравнить коэффициенты активности f (K+) в данных растворах и сделать вывод, как отличаются свойства этих растворов от свойств бесконечно разбавленных растворов KCl. Решение. Коэффициенты активности ионов K+ рассчитаем, используя закон Дебая-Хюккеля:
Коэффициент активности f - это мера отклонения в поведении раствора электролита данной концентрации от его поведения при бесконечном разведении раствора. Так как f 1 = 0,316 сильнее отклоняется от 1, чем f 2 = 0,891, то в растворе с большей ионной силой наблюдается большее отклонение в поведении раствора KCl от его поведения при бесконечном разведении. Вопросы для самоконтроля 1. Что такое электролитическая диссоциация? 2. Какие вещества называют электролитами и неэлектролитами? Приведите примеры. 3. Что такое степень диссоциации? 4. От каких факторов зависит степень диссоциации? 5. Какие электролиты считаются сильными? Какие средней силы? Какие слабыми? Приведите примеры. 6. Что такое константа диссоциации? От чего зависит и от чего не зависит константа диссоциации? 7. Как связаны между собой константа и степень диссоциации в бинарных растворах средних и слабых электролитов? 8. Почему растворы сильных электролитов в своем поведении обнаруживают отклонения от идеальности? 9. В чем заключается суть термина «кажущаяся степень диссоциации»? 10. Что такое активность иона? Что такое коэффициент актив-ности? 11. Как изменяется величина коэффициента активности с разбавлением (концентрированием) раствора сильного электролита? Каково предельное значение коэффициента активности при бесконечном разведении раствора? 12. Что такое ионная сила раствора? 13. Как вычисляют коэффициент активности? Сформулируйте закон Дебая-Хюккеля. 14. В чем суть ионной теории кислот и оснований (теории Аррениуса)? 15. В чем состоит принципиальное отличие протолитической теории кислот и оснований (теории Бренстеда и Лоури) от теории Аррениуса? 16. Как трактует электронная теория (теория Льюиса) понятие «кислота» и «основание»? Приведите примеры. Варианты задач для самостоятельного решения Вариант №1 1. Написать уравнение электролитической диссоциации Fe2(SO4)3. 2. Определить, чем с позиций теории Бренстеда является молекула H2O в реакции: НА + H2O ⇄ Н3O+ + А-. 3. Рассчитать величину Вариант №2 1. Написать уравнение электролитической диссоциации CuCl2. 2. Определить, чем с позиций теории Льюиса является ион S2- в реакции: 2Ag+ + S2- ⇄ Ag2S. 3. Вычислить молярную концентрацию электролита в растворе, если a = 0,75%, а Вариант №3 1. Написать уравнение электролитической диссоциации Na2SO4. 2. Определить, чем с позиций теории Льюиса является ион CN- в реакции: Fe3+ + 6CN- ⇄ [Fe(CN)6]3-. 3. Ионная сила раствора CaCl2 равна 0,3 моль/л. Рассчитать С(CaCl2). Вариант №4 1. Написать уравнение электролитической диссоциации Ca(OH)2. 2. Определить, чем с позиций теории Бренстеда является молекула H2O в реакции: H3O+ ⇄ H+ + H2O. 3. Ионная сила раствора K2SO4 составляет 1,2 моль/л. Рассчитать С(K2SO4). Вариант №5 1. Написать уравнение электролитической диссоциации K2SO3. 2. Определить, чем с позиций теории Бренстеда является ион NH4+ в реакции: NH4+ + H2O ⇄ NH3 + H3O+. 3. Вариант №6 1. Написать уравнение электролитической диссоциации K2S. 2. Определить, чем с позиций теории Льюиса является молекула AlBr3 в реакции: Br- + AlBr3 ⇄ [AlBr4]-. 3. Рассчитать ионную силу раствора, в 1 л которого содержится 0,5 моль NaNO3 и 0,5 моль CaCl2. Вариант №7 1. Написать уравнение электролитической диссоциации Fe(NO3)2. 2. Определить, чем с позиций теории Льюиса является ион Cl- в реакции: Cl- + AlCl3 ⇄ [AlCl4]-. 3. Рассчитать ионную силу раствора, в 1 л которого содержится 0,1 моль NH4NO3 и 0,1 моль Al2(SO4)3. Вариант №8 1. Написать уравнение электролитической диссоциации K2MnO4. 2. Определить, чем с позиций теории Бренстеда является ион HSO3- в реакции: HSO3- + OH– ⇄ SO32- + H2O. 3. Рассчитать значения коэффициентов активности всех ионов в растворе, содержащем KNO3, LiCl и NaBr, при условии, что концентрации всех электролитов одинаковы и составляют 0,2 моль/л. Вариант №9 1. Написать уравнение электролитической диссоциации Al2(SO4)3. 2. Определить, чем с позиций теории Льюиса является ион Co3+ в реакции: Co3+ + 6NO2- ⇄ [Co(NO2)6]3-. 3. В 1 л раствора содержится 0,348 г K2SO4 и 0,17 г NaNO3. Определить ионную силу этого раствора. Вариант №10 1. Написать уравнение электролитической диссоциации Ca(NO3)2. 2. Определить, чем с позиций теории Бренстеда является молекула H2O в реакции: B + H2O ⇄ OH- + BH+. 3. Вычислить концентрацию электролита в растворе, если a = 5%, а Вариант №11 1. Написать уравнение электролитической диссоциации KMnO4. 2. Определить, чем с позиций теории Льюиса является ион Cu2+ в реакции: Cu2+ + 4NH3 ⇄ [Cu(NH3)4]2+. 3. Вычислить коэффициент активности иона Cu2+ в растворе CuSO4 c С(CuSO4) = 0,016 моль/л. Вариант №12 1. Написать уравнение электролитической диссоциации Na2CO3. 2. Определить, чем с позиций теории Бренстеда является молекула H2O в реакции: K+ + xH2O ⇄ [K(H2O)x] +. 3. Имеются два раствора NaCl, содержащие и другие электролиты. Значения ионной силы этих растворов соответственно равны: I 1 = 0,1 моль/л, I 2 = 0,01 моль/л. Сравнить коэффициенты активности f (Na+) в данных растворах. Вариант №13 1. Написать уравнение электролитической диссоциации Al(NO3)3. 2. Определить, чем с позиций теории Льюиса является молекула RNH2 в реакции: RNH2 + H3O+ ⇄ RNH3+ + H2O. 3. Сравнить коэффициенты активности катионов в растворе, содержащем FeSO4 и KNO3, при условии, что концентрации электролитов составляют, соответственно, 0,3 и 0,1 моль/л. Вариант №14 1. Написать уравнение электролитической диссоциации K3PO4. 2. Определить, чем с позиций теории Бренстеда является ион H3O+ в реакции: HSO3- + H3O+ ⇄ H2SO3 + H2O. 3. Рассчитать значения коэффициентов активности всех ионов в растворе, содержащем CuSO4 и KCl, при условии, что концентрации электролитов одинаковы и составляют 0,01 моль/л. Вариант №15 1. Написать уравнение электролитической диссоциации K2SO4. 2. Определить, чем с позиций теории Льюиса является Pb(OH)2 в реакции: Pb(OH)2 + 2OH- ⇄ [Pb(OH)4]2-. 3. Рассчитать ионную силу раствора, в 1 л которого содержится 0,2 моль Cu(NO3)2 и 0,2 моль FeCl3. Вариант №16 1. Написать уравнение электролитической диссоциации Ni(NO3)2. 2. Определить, чем с позиций теории Бренстеда является ион гидроксония (H3O+) в реакции: 2H3O+ + S2- ⇄ H2S + 2H2O. 3. Ионная сила раствора, содержащего только Na3PO4, равна 1,2 моль/л. Определить концентрацию Na3PO4. Вариант №17 1. Написать уравнение электролитической диссоциации (NH4)2SO4. 2. Определить, чем с позиций теории Бренстеда является ион NH4+ в реакции: NH4+ + OH- ⇄ NH3 + H2O. 3. Ионная сила раствора, содержащего одновременно KI и Na2SO4, равна 0,4 моль/л. С(KI) = 0,1 моль/л. Определить концен-трацию Na2SO4. Вариант №18 1. Написать уравнение электролитической диссоциации Cr2(SO4)3. 2. Определить, чем с позиций теории Бренстеда является молекула белка в реакции:
3. Рассчитать ионную силу раствора, в 1 л которого содержится 0,1 моль KCl и 0,2 моль Na2S.
БЛОК ИНФОРМАЦИИ
Шкала значений pH
Эталоны решения задач 1. Концентрация ионов водорода в растворе составляет 10-3 моль/л. Рассчитать значения pH, pOH и [ОН-] в данном растворе. Определить среду раствора. Примечание. Для вычислений используются соотношения: lg10 a = a; 10lg a = а. Решение. 1) 2) 3) Среда раствора с pH = 3 является кислой, так как pH < 7. 2. Вычислить рН раствора соляной кислоты с молярной концентрацией 0,002 моль/л. Решение. Так как в разбавленном растворе НС1 1) 2) 3. К 10 мл раствора уксусной кислоты с C( Решение. 1) В исходном растворе слабой одноосновной кислоты СН3СООН:
Следовательно:
2) Добавление к 10 мл раствора кислоты 90 мл воды соответ-ствует 10-кратному разбавлению раствора. Поэтому:
Таким образом:
4. Найти значение рН раствора гидроксида кальция с молярной концентрацией эквивалента 0,002 моль/л, если Решение. В растворах сильных оснований:
5. рН раствора серной кислоты с молярной концентрацией 0,001 моль/л равен 2,72. Найти Решение. В растворе сильной кислоты:
Кислота двухосновная, следовательно, сначала необходимо определить молярную концентрацию эквивалента H2SO4 в растворе:
Зная величину pH раствора, можно рассчитать [H+]:
Отсюда:
6. Рассчитать рН раствора NaOH, если известно, что в 200 мл этого раствора содержится 0,0004 г NaOH ( Решение. В разбавленном растворе сильного основания:
Рассчитаем C(
7. Вычислить число ионов гидроксида, содержащихся в 5 мл раствора, водородный показатель которого равен 3. Решение. 1) 2) 3) Для вычисления числа ионов используется соотношение, связывающее число структурных единиц (атомов, ионов, молекул) вещества - N(x), количество этих структурных единиц - n(x) и постоянную Авогадро NА, равную 6,02·1023 моль-1:
Отсюда:
8. Рассчитать массу основания С5H5N·Н2О в 150 мл раствора, водородный показатель которого равен 10, если Решение. Массу основания в растворе можно вычислить, зная молярную концентрацию раствора. Так как С5H5N·Н2О - однокислотное основание, то из соотношения 14′: рС(осн) = 2·рОН - Величину рОН найдем из соотношения: рОН = 14 - рН = 14 - 10 = 4. Таким образом: рС(С5H5N·Н2О) = 2·4 - 5,2 = 2,8; С(С5H5N·Н2О) = 10-рС = 10-2,8 = 1,58·10-3 моль/л; m(С5H5N·Н2О) = С(С5H5N·Н2О)·М(С5H5N·Н2О)·Vр-ра = = 1,58·10-3·97·0,15 = 0,023 г. 9. Вычислить молярную концентрацию гидроксида калия в растворе, водородный показатель которого равен 12, если Решение. Гидроксид калия является однокислотным основанием, поэтому согласно соотношениям (8), (10) и (13):
10. Вычислить рН раствора азотной кислоты с C(HNO3) = 0,01 моль/л (расчет вести через активность ионов Н+). Решение.
Для определения коэффициента активности
Величину
Отсюда:
Если принять
Для точных расчетов сотые доли имеют значение. 11. Рассчитать рН раствора, в 100 мл которого находится 0,1 г гидроксида натрия и 0,174 г сульфата калия. Решение. Молярные концентрации электролитов в растворе составляют:
Ионная сила раствора, содержащего ионы Na+, K+, ОН- и SO42-, равна:
Коэффициент активности гидроксид-ионов и их активность соответственно равны:
Из соотношения (3) находим активность ионов водорода:
Таким образом:
12. Найти число недиссоциированных молекул кислоты в 500 мл раствора HF, если Решение. В растворе слабой одноосновной кислоты молярную концентрацию кислоты можно рассчитать по формуле (12):
Общее количество кислоты (n0) в заданном объеме раствора равно:
Количество недиссоциированной кислоты (n) найдем по формуле:
Число недиссоциированных молекул кислоты равно:
Вопросы для самоконтроля 1. Какие ионы образуются при диссоциации воды? Составьте выражение для константы диссоциации воды. 2. Что называется ионным произведением воды? Каково численное значение 3. Чем может быть вызвано изменение величины ионного произведения воды? 4. Изменится ли ионное произведение воды при добавлении к ней кислоты, щелочи или соли? 5. Являются ли концентрации ионов Н+ |


 К+ + ОН-
К+ + ОН-


 Al2(SO4)3 + (2x + 3y)H2O 2[Al(H2O)x]3+ + 3[SO4(H2O)y]2-,
Al2(SO4)3 + (2x + 3y)H2O 2[Al(H2O)x]3+ + 3[SO4(H2O)y]2-, Al2(SO4)3 2Al3+ + 3SO42-.
Al2(SO4)3 2Al3+ + 3SO42-. HCO3- + OH- CO32- + H2O (1),
HCO3- + OH- CO32- + H2O (1), HCO3- + H3O+ H2CO3 + H2O (2).
HCO3- + H3O+ H2CO3 + H2O (2). Ag+ + 2NH3 [Ag(NH3)2]+
Ag+ + 2NH3 [Ag(NH3)2]+ Na2SO4 2Na+ + SO42-
Na2SO4 2Na+ + SO42-
 CuSO4 Cu2+ + SO42-
CuSO4 Cu2+ + SO42-

 ,
, .
. Отсюда:
Отсюда: ,
, .
.




 (HA) = 6,4×10-7. Определить степень диссоциации HA в ее растворе с концентрацией 0,01 моль/л.
(HA) = 6,4×10-7. Определить степень диссоциации HA в ее растворе с концентрацией 0,01 моль/л.

 (HNO2) = 3,35. Сравнить силу HNO2 с силой одно-основной кислоты HA, степень диссоциации которой в растворе с С(HA) = 0,15 моль/л равна 15%.
(HNO2) = 3,35. Сравнить силу HNO2 с силой одно-основной кислоты HA, степень диссоциации которой в растворе с С(HA) = 0,15 моль/л равна 15%.





 = 10-5.
= 10-5. = 10-5.
= 10-5.
 Таблица 3. Взаимосвязь концентраций ионов H+ и OH-.
Таблица 3. Взаимосвязь концентраций ионов H+ и OH-. ], моль/л
], моль/л
 ], моль/л
], моль/л
 ;
;

 » 1, а в растворе одноосновной кислоты C(к-ты) = C(
» 1, а в растворе одноосновной кислоты C(к-ты) = C( к-ты), то можем записать:
к-ты), то можем записать: ,
,
 (СН3СООН) = 1,85×10-5.
(СН3СООН) = 1,85×10-5.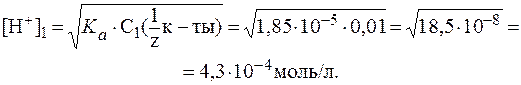






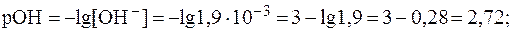

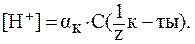


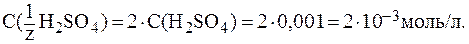

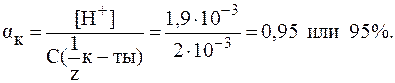
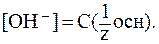
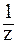 NaOH):
NaOH):





 .
.
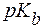 (С5H5N·Н2О) = 5,2.
(С5H5N·Н2О) = 5,2. .
. = 90 %.
= 90 %.

 сначала следует вычислить ионную силу раствора I:
сначала следует вычислить ионную силу раствора I:










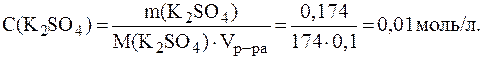






 = 10 %, pH = 2,5,
= 10 %, pH = 2,5,  .
. .
. .
.
 при 20-250С?
при 20-250С?


