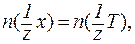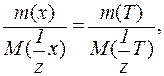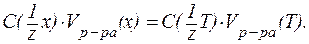Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Элементы количественного анализаСодержание книги
Поиск на нашем сайте
В настоящее время методы количественного анализа находят широкое применение в медицине и смежных с ней областях, а именно: - при клиническом исследовании биологических жидкостей (крови, мочи, слюны, спинномозговой жидкости, желчи), проводимом в целях постановки диагноза и назначения курса лечения; - при разработке, производстве и тестировании всех без исключения лекарственных средств; - при оценке экологической обстановки: санитарно-гигиенического обследования загрязненности воздуха, состояния водоемов, присутствия химических веществ в почве и продуктах питания и т. д. Количественный анализ представляет собой совокупность химических, физических, физико-химических методов анализа, позволяющих с требуемой точностью определять содержание отдельных составных частей в образце анализируемого вещества или их концентрации в растворе. Количественный анализ включает в себя весовой и объемный методы. Объемный (титриметрический) метод анализа Основу данного метода составляет измерение объема титранта (раствора с точно известной концентрацией), затраченного на реакцию с заранее известным точным объемом раствора анализи-руемого вещества (или его навески) до момента окончания реакции между ними (до наступления точки эквивалентности). Процесс постепенного добавления титранта к анализируемой пробе называется титрованием, а момент завершения реакции - точкой эквивалентности. В зависимости от типа реакции, лежащей в основе объемного определения, а также применяемых титрантов, различают несколько методов объемного анализа: 1) нейтрализации (кислотно-основного титрования); 2) осаждения; 3) оксидиметрии (перманганатометрии и иодометрии); 4) комплексонометрии. Реакции, используемые в объемном анализе, должны отвечать следующим требованиям: 1. Вещества должны реагировать в строго определенных количественных соотношениях. 2. Реакции должны протекать быстро и практически до конца. 3. Точка эквивалентности должна фиксироваться быстро и точно. 4. Титрование не должно сопровождаться побочными реакциями, искажающими результаты анализа. Расчеты в объемных методах анализа Закон эквивалентов Основой расчетов в любом методе является закон эквивалентов: Количество вещества эквивалента реагирующих между собой веществ одинаково. Условимся в дальнейшем любое анализируемое вещество обозначать х, а любой титрант Т. Тогда закон эквивалентов запишется:
Равенство количества вещества эквивалента можно также представить в виде:
Очевидно, что выражения (2) и (3) вытекают из уравнения (1). Поэтому в некоторых случаях в расчетах удобно применять комбинированные формы уравнений. Например:
Основными способами выражения концентраций растворов в объемном анализе являются молярная концентрация эквивалента вещества и титр раствора. Они связаны между собой следующими соотношениями:
Кислотно-основное титрование (метод нейтрализации) Основу метода составляет реакция нейтрализации: H+ + OH- = H2O. Данный метод используется: – для анализа желудочного сока (определение общей и свободной НСl), буферной емкости крови, спинно-мозговой жидкости; – при анализе лекарственных препаратов, относящихся к классам органических кислот (ацетилсалициловая, бензойная, никотиновая и др.) или оснований (водный раствор аммиака); – в санитарно-гигиенической оценке воды, определении содер-жания аммиака в питьевой и сточной воде и т. д. Методы кислотно-основного титрования Ацидиметрия -титрование с помощью кислот (титрант - кислота). Алкалиметрия -титрование с помощью щелочей (титрант - щелочь). Ацидиметрически определяют концентрации или массы оснований (KOH, NH4OH) и солей, имеющих вследствие гидролиза щелочную реакцию среды (Na2CO3, NaHCO3); алкалиметричес-ки - концентрации или массы кислот (HCl, H2SO4) и солей, имеющих вследствие гидролиза кислую реакцию среды (NH4Cl).
|
||||||||||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 256; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.14.134.18 (0.005 с.) |