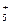Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Классификация органических реакций и их компонентов.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Любая химическая реакция включает разрыв (расщепление) связей между атомами и образование новых связей. В органической химии принято выделять два типа реагирующих частиц: субстрат — вещество, в котором происходит разрыв старых и образование новых связей с участием атома углерода, и реагент — вещество, под действием которого происходят изменения в субстрате. (Принято говорить об атакующем воздействии реагента на субстрат.) Например, в реакции Реакции с участием органических соединений подчиняются тем же законам, что и реакции в неорганической химии, хотя и имеют некоторые специфические особенности. Во-первых, разрыв связей может происходить по-разному с образованием различных промежуточных соединений. Во-вторых, изменению в ходе реакции подвергается, как правило, не вся молекула субстрата, а ее небольшая часть, включающая функциональную группу, кратную связь и т.п., называемая реакционным центром молекулы. Появление реакционных центров обусловлено неравномерным распределением электронной плотности в молекуле. В неорганической химии в реакциях обычно участвуют ионы, поэтому они протекают очень быстро, а иногда — мгновенно. В реакциях органической химии обычно участвуют молекулы, при этом разрываются одни ковалентные связи и образуются новые. Эти реакции протекают значительно медленнее, чем ионные, и для их успешного осуществления часто необходимы жесткие условия: повышенная температура, повышенное давление и катализаторы. В отличие от неорганических, органические реакции редко приводят к высокому выходу продукта (более 80 %), так как обычно протекает не одна, а несколько реакций. Поэтому в органической химии используются не химические уравнения, а схемы реакций, в которых обычно не приводятся стехиометрические соотношения между участниками, но указываются условия проведения реакции. Например, реакция этилена с водой, протекающая при повышенной температуре, повышенном давлении и в присутствии кислотного катализатора, записывается так:
В ходе большинства биохимических реакций изменению подвергается не вся молекула органического соединения, как это обычно бывает с неорганическими веществами, а только ее часть, которая называется реакционным центром. Реакционные центры в зависимости от природы и структуры имеют разную степень сродства к атакующим частицам, и их можно подразделять в зависимости от типа органической реакции. Реакции в органической химии принято классифицировать по механизму их протекания и по конечному результату химического превращения. По механизму протекания реакции делятся на гетеролитические (электпрофилъно-нуклеофилъные) и гомолитические (свободнорадикальные). Поскольку названия «электрофильно-нуклеофильные» или «свободнорадикальные» указывают на характер реагирующих частиц, то они используются в учебнике для харатеристики механизма реакции.
Электрофильно-нуклеофильные реакции сопровождаются гетеролизом полярной ковалентной связи между фрагментами (Аδ+ — Вδ–), причем так, что ее общая электронная пара сильно смещается к одному фрагменту молекулы где А и В обозначают атомы или группы атомов, связанные полярной ковалентной связью. При полном гетеролизе связь разрывается с образованием катиона А+ - сильного электрофила — и аниона В– - сильного нуклеофила. Процесс гетеролиза ковалентной связи можно рассматривать как расщепление этой связи по донорно-акцепторному механизму. Гетеролиз ковалентной связи происходит и в молекуле субстрата, и в молекуле реагента. Результатом электрофильно-нуклеофильной реакции является взаимодействие между фрагментами реагента и субстрата, проявляющими противоположные свойства. Электрофилами называются частицы или фрагменты молекул, содержащие свободную, доступную орбиталь и имеющие недостаток электронной плотности, которые в результате реакции образуют связь с новым нуклеофилом, акцептируя у него оба электрона на свою вакантную орбиталь. Электрофилами являются положительно заряженные частицы или фрагменты молекул, проявляющие высокое сродство к электронной паре нуклеофила: Н-электрофил: протон (Н+); С-электрофилы: карбкатионы (R3С О-электрофилы: S-электрофилы: N-электрофилы: Галогены, атомы которых несут частичный положительный заряд: Галδ+—Галδ-. В электрофильно-нуклеофильных реакциях электрофил выступает акцептором электронной пары нуклеофила. К электрофилам также относятся все кислоты (доноры протона) при кислотно-основном взаимодействии, все окислители (акцепторы электронов) при окислительно-восстановительном взаимодействии и все комплексоообразователи (акцепторы электронов) в реакциях комплексообразования. Нуклеофилами называются частицы или фрагменты молекул, содержащие подвижную электронную пару, которые в результате реакции образуют связь с новым электрофилом, отдавая ему эту электронную пару. Нуклеофилами являются отрицательно заряженные частицы или фрагменты молекул, проявляющие высокое сродство к электрофилу: С-нуклеофилы: карбанионы (R3Сө), металлоорганические соединения (R3C δ-—М δ+), ненасыщенные соединения (R2C=CR2, RC=CR); N-нуклеофилы: О-нуклеофилы: H2Ö, R— Ö—R', HÖ-, RÖ δ- —M δ+; S-нуклеофилы: H2 Галогенид-анионы: F-, Cl-, Br-, I-. В электрофильно-нуклеофильных реакциях нуклеофил выступает донором электронной пары. К нуклеофилам также относятся все основания при кислотно-основном взаимодействии, все восстановители при окислительно-восстановительном взаимодействии и все лиганды в реакциях комплексообразования. Таким образом, используемые в органической химии понятия электрофил и нуклеофил имеют более широкий смысл, чем понятия кислота и основание, окислитель и восстановитель, комплексообразователь и лиганд, используемые в неорганической химии. Однако суть электрофильно-нуклеофильных реакций, подобно кислотно-основным, окислительно-восстановительным и реакциям комплексообразования, также заключается в донорно-ак-цепторном взаимодействии компонентов с противоположными свойствами. Электрофильно-нуклеофильные свойства органических соединений проявляются прежде всего в их способности вступать в реакции: кислотно-основные, окислительно-восстановительные и комплексообразования. Органические соединения вступают также и в другие электрофильно-нуклеофильные реакции, которые нельзя отнести к вышеуказанным. В основном именно для этих реакций в данном учебнике будет использоваться термин «электрофильно-нуклеофильная реакция». Электрофилы и нуклеофилы характеризуются различной поляризуемостью и качественно подразделяются на жесткие (низкая поляризуемость) и мягкие (высокая поляризуемость). Жесткие электрофилы имеют сравнительно большой положительный заряд, а их свободная орбиталь, на которую перейдет электронная пара нуклеофила, имеет низкий уровень энергии. Жесткими электрофилами являются: Н+, Na+, К+, Mg2+, Ca2+, Mn2+, Al3+, A1C13, BF3, R Жесткие нуклеофилы хорошо удерживают свою электронную пару, поскольку ее орбиталь расположена близко к ядрам атомов и имеет низкий уровень энергии. Донорными атомами в жестких нуклеофилах могут быть кислород, азот, хлор, фтор. Жесткими нуклеофилами являются: Н2О, ОН-, ROH, RO-, ROR, RCOO-, NH3, RNH2, RNH-, Cl-, F-. Жесткие нуклеофилы трудно окисляются. Мягкие электрофилы содержат акцепторные атомы большого размера с невысокой электроотрицательностью и с малым положительным зарядом. Их свободная орбиталь, принимающая электронную пару нуклеофила, имеет высокий уровень энергии. Мягкими электрофилами являются: Hg2+, Cu+, Ag+, —I δ+, -Br δ+ Мягкие нуклеофилы плохо удерживают свою электронную пару, поскольку ее орбиталь удалена от ядер атомов и имеет высокий уровень энергии. Донорными атомами в мягких нуклеофилах выступают атомы серы, иода и углерода. Мягкими нуклеофилами являются: RS-, RSR, RSH, I-, RC=CR, R2C=CR2 Мягкие нуклеофилы довольно легко окисляются. Существуют электрофилы и нуклеофилы, которые занимают промежуточное положение. Электрофилы: Cu2+, Fe2+, Zn2+, R3C+, C6H Нуклеофилы: Br~, C6H5 В соответствии с принципом Пирсона более стабильная связь образуется при взаимодействии жесткого электрофила с жестким нуклеофилом или мягкого электрофила с мягким нуклеофилом. На основе этого принципа можно качественно оценить реакционную способность при взаимодействии нуклеофилов и электрофилов различного типа.
|
||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 639; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.116.77 (0.01 с.) |

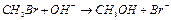 расщепляется связь С—Вr и образуется связь С—О; в качестве субстрата выступает
расщепляется связь С—Вr и образуется связь С—О; в качестве субстрата выступает 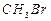 , в качестве реагента -
, в качестве реагента - 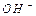 .
.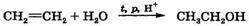
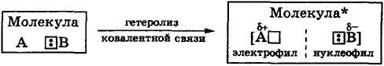
 Вδ–, превращая его в нуклеофил, а у другого фрагмента возникает дефицит электронов (Аδ+
Вδ–, превращая его в нуклеофил, а у другого фрагмента возникает дефицит электронов (Аδ+  ), превращая его в электрофил:
), превращая его в электрофил: ) или соединения с сильнополярной связью
) или соединения с сильнополярной связью 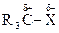 ,
, 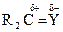 ,
, 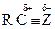
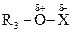 ;
;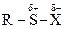 ;
;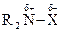 ,
, 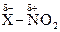 ;
;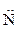 H3, R
H3, R 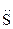 , R—
, R— 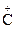 =O
=O