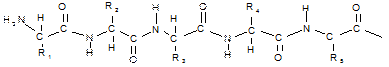Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Строение и свойства аминокислот.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
(Самостоятельная работа студентов)
Аминокислоты — соединения, в молекулах которых одновременно присутствуют амино- и карбоксильные группы.
Природные α-аминокислоты являются биологически активными соединениями; их классификация приведена в табл. 19. Строение аминокислот. Все α-аминокислоты* можно рассматривать как результат замены атома водорода в простейшей а-аминокислоте — глицине — на тот или иной радикал R. Таким образом, в соответствии с природой радикала R, называемого боковой цепью, -аминокислоты подразделяют на 4 группы, отличающиеся гидрофильностью или гидрофобностью боковых цепей, а также способностью боковой цепи проявлять кислотные или основные свойства (см. табл. 19). Аминокислоты рассматриваются как производные карбоновых кислот, в которых положение аминогруппы относительно карбоксильной принято указывать буквами α, β, γ и т. д., что равносильно цифрам 2, 3, 4 и т. д. соответственно. Хотя в природных объектах и обнаружено около 300 разных аминокислот, но в состав большинства пептидов и белков входят 20 наиболее часто встречающихся и поэтому важных аминокислот, причем все они α-аминокислоты. Таким образом, в α-аминокислотах карбоксильная и аминогруппы связаны с одним и тем же углеродным атомом (Сα), у которого кроме того имеется заместитель R. R — неполярный углеводородный заместитель, проявляющий гидрофобные (липофильные) свойства. Это восемь α-аминокислот: аланин, валин, лейцин, изолейцин, пролин, фе-нилаланин, триптофан и метионин, труднорастворимые в воде. R — неионизующийся полярный заместитель, проявляющий гидрофильные свойства. Это пять α-аминокислот, которые лучше растворяются в воде: глицин, серии, треонин, аспарагин и глутамин. R — полярный заместитель, проявляющий гидрофильные и кислотные свойства. Это четыре α-аминокислоты: аспарагиновая и глутаминовые кислоты, цистеин и тирозин. В аспарагиновой и глутаминовой кислотах заместитель полностью отдает протон своей карбоксильной группы в растворах с рН = 7 и поэтому, в этих условиях несет отрицательный заряд.
Таблица Важнейшие α-аминокислоты кислотно-основные характеристики
Стереохимия природных α-аминокислот характеризуется тем, что все они кроме глицина имеют асимметрический атом углерода (атом, связанный и с амино-, и с карбоксильной группой), конфигурация которого может быть отождествлена с конфигурацией L-глицеринового альдегида путем цепи химических превращений:
* За исключением нейтральной гидрофобной аминокислоты пролина (L-пирролидин-α-карбоновой кислоты). При этом превращения либо не должны затрагивать хиральный центр, либо реакции должны протекать строго стереоспецифично. Следовательно, все природные α-аминокислоты являются L-энантиомерами. Конфигурация асимметрического центра аминокислот определяет биологические свойства как самих аминокислот, так и олиго- и полимерных соединений, мономерами которых служат остатки аминокислот (эти соединения называют пептидами ) Свойства аминокислот. Аминокислоты представляют собой бесцветные кристаллические вещества с довольно высокими температурами плавления (более 230 °С). Большинство кислот хорошо растворимы в воде и практически не растворимы в спирте и диэтиловом эфире, что указывает на солеобразный характер этих веществ. Специфическая растворимость аминокислот обусловлена наличием в молекуле одновременно аминогруппы (имеющей основный характер) и карбоксильной группы (характеризующейся кислотными свойствами), благодаря чему аминокислоты принадлежат к амфотерным электролитам (амфолитам). В водных растворах и твердом состоянии аминокислоты существуют только в виде внутренних солей — цвиттер-ионов.
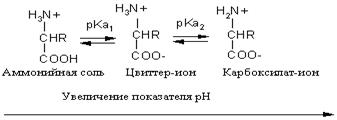
Кислотно-основное равновесие для аминокислоты может быть описано следующим образом:
Если к раствору аминокислоты приложено электрическое поле, то в зависимости от показателя рН раствора ионы аминокислоты будут перемещаться по-разному: в кислой среде при рН < 7 аммонийные ионы аминокислот перемещаются к отрицательному полюсу (катоду), а в щелочной среде при рН > 7 карбоксилат-ионы — к положительному полюсу (аноду). Значение рН, при котором молекула аминокислоты электронейтральна, называют изоэлектрической точкой и обозначают р I. При значении рН, равном показателю р I, молекула аминокислоты в электрическом поле не перемещается. Изоэлектрическую точку определяют по соотношению p I =0.5(p K a1+p K a2)
Реакции с участием только аминогруппы. Наличие в молекуле одновременно амино- и карбоксильной группы отражается и на поведении аминокислот в тех реакциях, в которых участвует только одна из двух функциональных групп. Аминогруппа, которая в аминах проявляет себя как нуклеофил, в биполярном ионе полностью лишена нуклеофильности из-за протонирования, поэтому ни реакция алкилирования по Гофману, ни ацилирование, свойственные аминам, не имеют места в случае аминокислот. Эти реакции могут происходить только при условии предварительного депротонирования аминогруппы, что достигается использованием реакционной среды с высоким значением рН, при которых цвиттер-ион полностью превращен в карбоксилат-анион. Рассмотрим основные реакции с участием только аминогруппы аминокислот. 1. Алкилирование осуществляют, действуя на полученные соли аминокислот алкилгалогенидами в присутствии оснований (как органических, так и неорганических). 2. Ацилирование также требует предварительного превращения цвиттер-иона в карбоксилат-анион и успешно протекает при наличии в реакционной среде эквивалента основания (основание необходимо для связывания выделяющегося при ацилировании кислого продукта — галогеноводорода или карбоновой кислоты):
или
и далее
3. Образование оснований Шиффа (как типичная реакция аминов) свойственно и аминокислотам; наиболее часто используют реакции аминокислот с бензальдегидом:
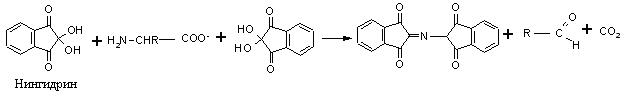
На образовании оснований Шиффа основана реакция идентификации аминокислот, известная как «нингидриновая проба», широко применяемая для визуализации зон аминокислот (возникает интенсивное сине-фиолетовое окрашивание) при их хроматографическом и электрофоретическом разделении, а также для количественного определения содержания аминокислот в растворах:
4. Дезаминирование аминокислот, как и всякого первичного амина, протекает при действии на аминокислоты азотистой кислоты:
Эта реакция лежит в основе метода определения содержания азота и количества аминогрупп в аминокислотах (метод Ван-Слайка ). Биосинтез аминокислот. Все природные α-аминокислоты делят на незаменимые (валин, гистидин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин), которые поступают в организм только из внешней среды, и заменимые, синтез которых происходит в организме.
Биосинтез α-аминокислот может происходить на основе не аминокислот, например по реакции восстановления
Реакция стереоспецифична вследствие стереоспецифичности НАДН. В качестве исходных веществ при биосинтезе аминокислот могут выступать другие аминокислоты. Например, реакция трансаминирования (переаминирования) является основной при синтезе α-аминокислот в организме:
Катализаторами и участниками этого процесса являются ферменты (аминотрансферазы) и кофермент пиридоксальфосфат, который служит переносчиком аминогруппы. § 8.2. Пептиды.
Амино- и карбоксильные группы аминокислот могут реагировать друг с другом, даже если они находятся в одной молекуле. Еще более реальным является образование межмолекулярной амидной связи. Амиды, образовавшиеся в результате взаимодействия некоторого числа аминокислот, называют пептидами. В зависимости от числа аминокислотных остатков различают ди-, три-, тетра-, пентапептиды и т.д. При этом пептиды молекулярной массой не более 10 000 называют олигопептидами; молекулярной массой более 10 000 — полипептидами, или белками. Амидные связи в составе пептидов называют пептидными. Пептидная группировка характеризуется рядом свойств. 1. Пептидная группировка имеет жесткую планарную структуру, т. е. все атомы, входящие в нее, располагаются в одной плоскости. 2. Атомы кислорода и водорода пептидной группировки природных пептидов и белков находятся в транс -положении по отношению к связи С—N, так как при транс -конфигурации заместителей боковые цепи оказываются наиболее удалены друг от друга, что важно для стабилизации структуры белковой молекулы. 3. Пептидная группа представляет собой трехцентровую ρ, π-сопряженную систему, которая образуется вследствие делокализации электронной плотности между атомами кислорода, углерода и азота. Длины связей С—О и С—N оказываются практически одинаковыми. 4. Пептидная связь устойчива при температуре 310 К в средах, близких к нейтральной (физиологические условия). В кислой и щелочной средах связь подвергается гидролизу. В условиях организма гидролиз происходит ферментативно. 5. Дополнительные, как правило, нековалентные связи между пептидной группой и боковыми цепями обусловливают существование различных конформаций белковой молекулы. Например, внутримолекулярные водородные связи
6. Пептидная группировка может существовать в двух резонансных формах (кетонной и енольной):
Эти свойства пептидной группировки определяют строение полипептидной цепи:
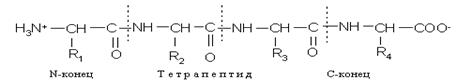
Полипептидная цепь состоит из регулярно повторяющихся участков, образующих остов молекулы, и вариабельных участков — боковых радикалов аминокислотных остатков. Началом полипептидной цепи считают конец, несущий свободную аминогруппу (N-конец), а заканчивается полипептидная цепь свободной карбоксильной группой (С-конец).
Как правило, при изображении формулы пептида N-конец располагают слева, а С-конец — справа:
Называют пептид, последовательно перечисляя, начиная с N-конца, названия аминокислот, входящих в пептид; при этом суффикс «ин» заменяют на суффикс «ил» для всех аминокислот, кроме С-концевой. Для описания строения пептидов применяют не традиционные структурные формулы, а сокращенные обозначения, позволяющие сделать запись более компактной. Понятие «строение пептида» (равно как и «структура белка») включает в себя следующие характеристики: 1) общее число аминокислотных остатков; 2) перечень аминокислот, входящих в состав пептида, и указание количества аминокислотных остатков каждого вида (этот параметр называют аминокислотным составом пептида или белка ); 3) последовательность связывания аминокислот друг с другом (этот параметр называют аминокислотной последовательностью; он отражает так называемую первичную структуру пептида или белка); последовательность записывают слева направо от N-конца к С-концу.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 817; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.100.233 (0.014 с.) |

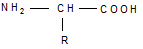
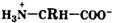 и их
и их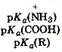
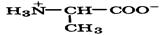
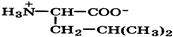
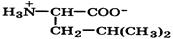
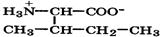


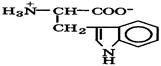
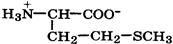
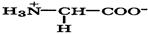
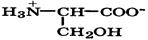

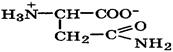
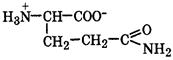
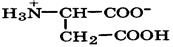
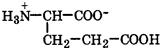
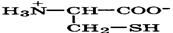
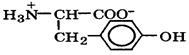
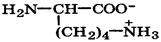
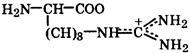
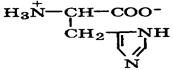

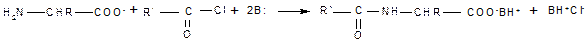


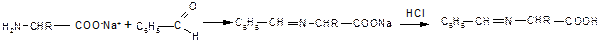
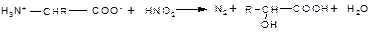
 -кетокислот под действием НАДН:
-кетокислот под действием НАДН: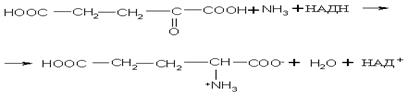
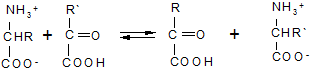
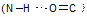 стабилизируют вторичную структуру белка.
стабилизируют вторичную структуру белка.