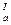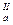Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Некоторые дикарбоновые кислоты, их названия и кислотные свойстваСодержание книги
Поиск на нашем сайте
Все дикарбоновые кислоты — кристаллические вещества, причем кислоты с четным числом углеродных атомов плавятся при более высокой температуре, чем соседние гомологи с нечетным числом углеродных атомов.
Дикарбоновые кислоты диссоциируют последовательно, так как отрыв протона от молекулы кислоты всегда происходит легче, чем от ее аниона: НООС—СООН <=> НООС—СОСГ + Н+ pК НООС—СОО– <=> –ООС—СОО– + Н+ рК
Кислотные свойства этих кислот, особенно первых представителей, значительно выше, чем монокарбоновых кислот. Это объясняется электроноакцепторным влиянием второй карбоксильной группы, а в случае щавелевой кислоты еще и большей возможностью делокализации отрицательного заряда в ее анионах. Наиболее сильной кислотой является щавелевая, а кислотность глутаровой кислоты мало отличается от кислотности уксусной (рКа = 4,76), что связано с уменьшением взаимного индуктивного влияния карбоксильных групп при их отдалении друг от друга. Дикарбоновые кислоты способны образовывать два вида функциональных производных: неполные, т. е. по одной карбоксильной группе, и полные — по обеим карбоксильным группам: HOOC—COONa NaOOC—COONa HOOCCH2COOC2H5 C2H5OOCCH2COOC2H5 гидрооксалат натрия оксалат натрия этилмалонат диэтилмалонат (кислая соль) (средняя соль) (неполный эфир) (полный эфир)
Кальциевые соли щавелевой кислоты малорастворимы, и поэтому они являются причиной образования оксалатных камней в почках и мочевом пузыре. Специфические свойства дикарбоновых кислот, обусловленные наличием в молекуле двух карбоксильных групп, проявляются прежде всего в их склонности к реакциям окислительно-восстановительной дисмутации и реакциям дегидратации. Так, щавелевая и малоновая кислоты при нагревании легко декарбоксилируются с образованием монокарбоновой кислоты с укороченной углеродной цепью: +3 +3 t +2 +4 HOOC—COOH → HCOOH + СO2 +3 -2 -3 +4 HOOC—CН2—COOH → CН3COOH + СO2 Легкость протекания реакции декарбоксилирования у ди- и особенно трикарбоновых кислот используется во многих биохимических процессах. Дикарбоновая кислота с достаточно длинной цепью может изогнуться в виде клешни, при этом карбоксильные группы окажутся близко расположены, что характерно уже для янтарной и глутаровой кислот. Поэтому при нагревании этих кислот происходит реакция внутримолекулярного ацилирования, сопровождаемая дегидратацией, с образованием устойчивых пяти- и шестичленных циклических ангидридов:
янтарная кислота янтарный ангидрид
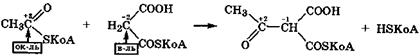
Характерной особенностью малоновой кислоты и особенно ее эфиров является то, что ее α-метиленовая группа, активированная двумя соседними карбонильными группами, легко вступает в качестве нуклеофила-восстановителя в реакции конденсации (С-ацилирования):
Эта реакция используется в организме при биосинтезе жирных кислот. Янтарная кислота содержит две активированные метиленовые группы, и поэтому в организме она легко дегидрируется окисленной формой кофермента ФАД сукцинатдегидрогеназы:
янтарная кислота (окислитель) фумаровая кислота (восстановитель)
Реакция протекает стереоспецифично с отщеплением водородных атомов в троке-положении с образованием фумаровой кислоты. Эта реакция является одной из стадий цикла Кребса. Дикарбоновые кислоты являются бидентатными лигандами и легко образуют прочные хелатные комплексы.
|
|||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 673; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.219.81.129 (0.007 с.) |