Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основные типы органических реакцийСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
В органической химии электрофильно-нуклеофильные реакции принято называть по характеру частицы, которой реагент атакует субстрат. Этот выбор можно объяснить тем, что реагент обычно является более простой молекулой, в которой проще определить состав электрофильного и нуклеофильного фрагмента и их активность, а следовательно, и характер атакующей частицы.
Нуклеофильной называется реакция, при которой реагент атакует субстрат своим нуклеофилом; она обозначается индексом N (nucleophlle).
В нуклеофильных реакциях реагент принято называть нуклеофилом. В органической химии нуклеофильность реагента характеризует его способность взаимодействовать с атомом углерода субстрата, несущим полный или частичный положительный заряд. Электрофильной называется реакция, при которой реагент атакует субстрат своим электрофилом; она обозначается индексом Е (electrophile).
В электрофильных реакциях реагент принято называть электрофилом. В органической химии электрофильность реагента характеризует его способность взаимодействовать с атомом углерода субстрата, несущим полный или частичный отрицательный заряд. В действительности механизм и результат любой электрофильно-нуклеофильной реакции определяется не только свойствами реагента, но и свойствами субстрата, образующихся продуктов реакции, растворителя и условиями ее проведения. Поэтому разделение электрофильно-нуклеофильных реакций на нуклеофильные и электрофильные только по свойствам реагента носит условный характер. Кроме того, как видно из приведенных схем, в этих реакциях всегда взаимодействуют между собой электрофилы и нуклеофилы, содержащиеся в субстрате и реагенте. Во многих реакциях лишь условно один компонент может считаться субстратом, а другой – реагентом. Свободнорадикальные реакции. Гомолитический распад характерен для неполярной или малополярной связи. Он сопровождается образованием свободных радикалов — частиц с неспаренным электроном. Гомолиз ковалентной связи можно рассматривать как расщепление этой связи по обменному механизму. Для осуществления гомолиза связи необходима энергия (теплота, свет), достаточная для того, чтобы разорвать эту связь. Наличие неспаренного электрона является причиной малой стабильности свободных радикалов (время жизни в большинстве случаев составляет доли секунды) и высокой реакционной способности в свободнорадикальных реакциях. Присутствие в системе свободного радикала (R۰) может приводить к образованию новых радикалов вследствие его взаимодействия с имеющимися молекулами: R۰ + А – В → R – A + ۰В
Свободнорадикальные реакции сопровождаются взаимодействием свободных радикалов с молекулами или между собой с образованием новых свободных радикалов (зарождение или развитие цепи) или только молекул (обрыв цепи). Для свободнорадикальных реакций характерен цепной механизм, который включает три стадии: зарождение, развитие и обрыв цепи. Эти реакции прекращаются при исчезновении в системе свободных радикалов. Свободнорадикальные реакции обозначаются индексом R (radical). Радикальные частицы в зависимости от их сродства к электрону могут и принимать электроны (т. е. быть окислителями), и отдавать электроны (т. е. быть восстановителями). При этом сродство радикала к электрону определяется не только его свойствами, но и свойствами его партнера по реакции. Особенности процессов свободнорадикального окисления-восстановления, протекающих в организме, рассматриваются отдельно при описании свойств определенных классов органических соединений. В реакциях комплексообразования радикалами могут быть и комплексообразователь, и лиганды. В случае комплексов с переносом заряда радикалообразование может происходить внутри комплекса за счет внутримолекулярного окисления-восстановления между комплексообразователем и лигандом. Образование радикалов легче всего происходит при гомолизе неполярных простых связей между атомами одного и того же элемента: С12 → С1۰ + ۰С1 НО—ОН → НО۰ + ۰ОН R—О—О—R' → RO۰ + ۰OR' R—S—S—R' →RS۰ + ۰SR' При гомолизе малополярной связи С—Н образуются алкильные радикалы, в которых неспаренный электрон находится у атома углерода. Относительная устойчивость этих радикалов зависит от типа замещения атома углерода, несущего неспаренный электрон, и растет в ряду: •СН3 < •CH2R < •CHR2 < •CR3. Это объясняется положительным индуктивным эффектом алкильных групп, который, повышая электронную плотность на атоме углерода, способствует стабилизации радикала.
Стабильность свободных радикалов существенно возрастает, когда имеется возможность делокализации неспаренного электрона за счет π-электронов соседних кратных связей. Это особенно наглядно наблюдается в аллильном и бензильном радикалах:
аллильный радикал бензильный радикал
В ходе ознакомления с возможными механизмами реакций в молекулах субстрата и реагента следует различать реакционные центры по их характеру: нуклеофильные, электрофилъные и радикальные. По конечному результату химического превращения простейшие органические реакции классифицируются на реакции: замещения, присоединения, элиминирования (отщепления) и перегруппировки. Реакции замещения. Под замещением понимают замену атома или группы на другой атом или группу. В реакции замещения всегда образуются два различных продукта. Этот тип реакций обозначается символом S (substitution). К реакциям замещения относятся: галогенирование и нитрование алканов, этерификация и алкилирование карбоновых кислот, а также многочисленные реакции взаимодействия простых полярных молекул (Н2О, NH3, НГал) с эфирами, спиртами и галогенпроизводными. Реакции присоединения. Под присоединением понимают введение атомов или групп в молекулу непредельного соединения, сопровождаемое разрывом π-связей. При этом двойные связи превращаются в ординарные, а тройные связи - в двойные или ординарные. Этот тип реакций обозначается символом A (addition). Реакции элиминирования (отщепления). Под элиминированием понимают отщепление атомов или групп от органической молекулы с образованием кратной связи. Поэтому реакции элиминирования обратны реакциям присоединения. Этот тип реакции обозначается символом Е (elimination). Каждая из органических реакций замещения (S), присоединения (А) или элиминирования (Е) может быть электрофильной (Е), нуклеофильной (N) или радикальной (R). Таким образом, в органической химии выделяют девять типовых реакций, обозначаемых символами S, А или Е с индексами R, N или Е:
Приведенные типы органических реакций следует считать модельными, так как они не всегда реализуются в чистом виде. Так, например, замещение и элиминирование могут протекать одновременно:
Реакции перегруппировки. В процессе перегруппировки происходит перемещение (миграция) одних атомов или групп ют одного фрагмента молекулы к другому без изменения ее брутто-формулы. Перегруппировки органических соединений происходят обычно в присутствии катализатора и сопровождаются окислительно-восстановительной дисмутацией атомов углерода:
При дальнейшем знакомстве с конкретными классами органических соединений нами будут рассматриваться следующие их химические свойства: кислотно-основные, комплексообразующие, окислительно-восстановительные, электрофильно-нуклеофильные, а также способность к свободнорадикальному взаимодействию. Особое внимание будет уделено особенностям протекания рассматриваемых реакций в биологических системах.
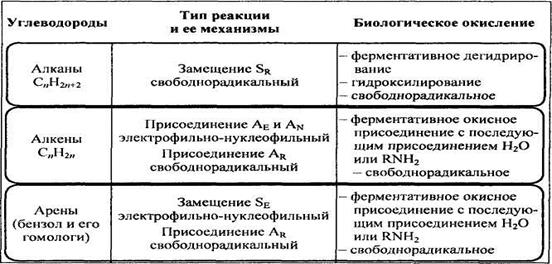
Типы реакций, характерные для различных классов углеводородов, механизм их протекания и биологическое значение процессов представлены в таблице 10.
|
|||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 1001; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.205.30 (0.011 с.) |