Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Пространственное строение органических соединений. СтереоизомерияСодержание книги
Поиск на нашем сайте Пространственная изомерия в молекуле обусловлена различным пространственным расположением атомов при одинаковом порядке их связывания. Стереоизомеры - изомеры, имеющие одинаковую последовательность химических связей атомов, но различное расположение этих атомов относительно друг друга в пространстве. Стереоизомеры могут различаться конформацией и конфигурацией. Конформациями молекулы называются различные ее пространственные формы, возникающие в результате вращения атомов или групп вокруг ординарных связей. Стереоизомеры, различие между которыми обусловлено поворотом отдельных участков молекулы вокруг ординарных связей, называются конформерами. Наиболее стабильными и энергетически выгодными конформерами являются те, в которых между несвязанными атомами или их группами межатомное отталкивание наименьшее; их называют заторможенными конформерами. Конформеры, где атомы или их группы расположены близко друг к другу, являются нестабильными и называются заслоненными. Переходной формой между заторможенной и заслоненной конформациями является скошенная конформация.Фактически различные конформеры находятся в динамическом равновесии, и возможность перехода одного конформера в другой определяется энергетическим барьером вращения, который составляет 10-50 кДж/моль. Поскольку энергетический барьер вращения невелик, то переход из одной конформации в другую осуществляется легко, и поэтому выделить конформеры в качестве устойчивых изомеров нельзя. Внутреннее вращение вокруг простых связей ограничивается или даже затормаживается в случае высокого энергетического барьера вращения. Для изображения результатов вращения по связи С—С удобно пользоваться проекционными формулами Ньюмена (1955). Эти проекции получают, рассматривая молекулу вдоль С—С связи, вокруг которой происходит вращение. Ближайший к наблюдателю атом углерода обозначается точкой пересечения его связей
Рис. 2. Проекции Ньюмена и стереохимические формулы заслоненного и заторможенного конформеров молекулы этана
В длинных углеродных цепях вращение возможно вокруг нескольких С—С связей. Поэтому вся цепь может принимать разнообразные геометрические формы, среди которых зигзагообразная конформация наиболее устойчива. Именно эта конформация характерна для гидрофобных фрагментов природных жирных кислот и их производных. В циклических соединениях вращение вокруг ординарных связей ограничено, что приводит к возникновению определенных конформаций. В природных соединениях особенно часто встречается фрагмент, содержащий циклогексановый цикл. Атомы углерода в этом цикле находятся в состоянии sр3-гибридизации, и, следовательно, их химические связи не лежат в одной плоскости. У циклогексана возникают два конформера типа кресла и ванны (рис. 3).
Рис. 3. Циклогексан в конформациях ванны и кресла
В конформации «кресло», в отличие от конформации «ванна», не имеется заслоненных положений атомов водорода, поэтому она термодинамически более устойчива. При комнатной температуре молекулы циклогексана существуют практически только в конформации кресла. Производные циклогексана, содержащие два и более объемных заместителя, имеют такую конформацию, в которой эти заместители располагаются наиболее удаленно друг от друга, например по разные стороны от плоскости цикла. Биологическое действие многих лекарственных веществ и биорегуляторов (гормоны, витамины, антибиотики и др.) тесно связано с пространственным строением их молекул. Для наиболее полного связывания этих веществ рецепторами клетки они должны иметь определенную конформацию. Изменение конформаций, как правило, снижает степень связывания и ослабляет биологическое действие. О конформации белков, полисахаридов и нуклеиновых кислот речь пойдет в соответствующих разделах. Стереоизомеры могут отличаться не только конформацией, но и конфигурацией. Конфигурациями молекул называются разные пространственные расположения атомов или групп, которые не могут быть переведены друг в друга простым вращением вокруг связей. В отличие от конформационных изомеров, которые легко превращаются друг в друга, конфигурационные изомеры устойчивы. Различают два вида конфигурационной изомерии: геометрическую, или цис-транс-изомерию, и оптическую изомерию. Геометрическая изомерия. Стереоизомеры, отличающиеся друг от друга расположением заместителей по отношению к плоскости двойной связи или цикла, называются геометрическими изомерами. Изомер, содержащий одинаковые заместители по одну сторону от плоскости связи (цикла), называется цис-изомером, а если они расположены с противоположных сторон — транс-изомером:
Цис-транс-изомеры отличаются друг от друга не только физическими и химическими свойствами, но и биологической активностью, что определяет различное их участие в физиологических процессах биосистем.
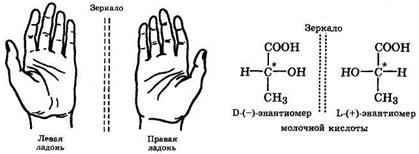
Геометрическая изомерия часто встречается среди природных соединений, в частности сопряженных полиенов. Так, ретиналь-активная форма витамина А представлена в организме в виде транс-изомера, который под действием фермента ретинальизомеразы превращается в цис-ретиналь. При поглощении света протекает фотоизомеризация цис-ретиналя обратно в транс-изомер. Эта реакция лежит в основе возбуждения палочек сетчатки глаза. Оптическая изомерия. Она характерна для несимметричных соединений, у которых в молекуле имеется атом углерода в состоянии sрЗ-гибридизации, связанный с четырьмя различными атомами или группами. Такой атом углерода называется асимметрическим и обозначается С*. Оптические изомеры отличаются друг от друга как несимметричный предмет от своего изображения в зеркале, и их нельзя перевести друг в друга путем внутреннего вращения (рис. 4). Другими словами, изомеры L и D относятся друг к другу как левая рука к правой и они несовместимы. Это свойство называется хиралъностью (от греч. χειρος – рука), а асимметрический атом - хиральным центром. В большинстве случаев наличие хирального атома в молекуле уже служит указанием на ее хиральность.
Рис. 4. Хиральные объекты
Наиболее важным следствием хиральности молекул является существование их в виде пары пространственных изомеров – энантиомеров, представляющих нсовместимые в пространстве зеркальные изображения (зеркальные антиподы).
|
|||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 1009; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.009 с.) |

 , а удаленный от наблюдателя атом углерода и его связи - окружностью с линиями
, а удаленный от наблюдателя атом углерода и его связи - окружностью с линиями  . На рис. 2 при помощи проекций Ньюмена и стереохимических формул изображено вращение метильных групп вокруг связи С—С в молекуле этана.
. На рис. 2 при помощи проекций Ньюмена и стереохимических формул изображено вращение метильных групп вокруг связи С—С в молекуле этана.