Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Строение и свойства углеводов.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Углеводы - полифункциональные соединения, широко распространенные в животном и растительном мире; они выполняют исключительную роль во многих жизненных процессах. Углеводы составляют 80% от сухой массы растений и 2% от сухой массы животных организмов. Углеводы в живой природе имеют большое значение, в первую очередь, как источники запасной энергии в метаболических процессах (в растениях - крахмал, в животных организмах - гликоген); как структурные компоненты клеточных стенок растений (целлюлоза), бактерий (мурамин), грибов и насекомых (хитин). Углеводы являются составными элементами ряда жизненно важных веществ (нуклеотиды, нуклеиновые кислоты, коферменты, витамины). Некоторые углеводы и их производные являются лекарственными средствами. Источником углеводов для всех растений является фотосинтез. Животные организмы не способны синтезировать углеводы, а получают их с пищей растительного происхождения, а затем используют их для выработки энергии для жизнедеятельности. Углеводы составляют значительную долю пищи млекопитающих. Человек употребляет в сутки около 500 г углеводов.
§ 9.1. 1. Классификация углеводов. I. По способности к гидролизу все углеводы можно подразделить на следующие группы: 1. Моносахариды (монозы) - это простейшие углеводы, которые не гидролизуются (глицериновый альдегид, рибоза, глюкоза, фруктоза). Моносахариды – твердые вещества, легко растворимые в воде, их растворы имеют нейтральную среду, большинство из них обладают сладким вкусом. 2. Дисахариды - можно рассматривать как продукт диконденсации моноз, подвергаются гидролизу и образуют два моносахарида (лактоза, сахароза, мальтоза). 3. Олигосахариды - сложные углеводы, при гидролизе дают от 2 до 10 молекул моносахаридов. 4. Полисахариды - высокомолекулярные углеводы, при гидролизе образуют сотни и тысячи молекул моносахаридов (крахмал, гликоген, гиалуроновая кислота, гепарин). П. По характеру функциональных групп моносахариды делятся на альдозы и кетозы.
Поколичеству углеродных атомов моносахариды делятся на триозы (три атома углерода) – глицериновый альдегид (г.а.); тетрозы (четыре атома) – эритроза; пентозы (пять атомов) - ксилоза, рибоза; гексозы – глюкоза, фруктоза и гептозы:
. Моносахариды (монозы). Это гетерополифункциональные соединения, содержащие карбонильную и несколько гидроксильных групп. Моносахариды имеют молекулярную формулу Сn(Н2О)n которая и послужила основой для названия данного класса соединений (углерод + вода). По своей структуре монозы относятся к полиоксиальдегидам, или альдозам (рис. 5.2), и полиоксикетонам, или кетозам. Моносахариды – (простые сахара) – бесцветные кристаллические вещества, хорошо растворяющиеся в воде, но не растворимые в неполярных растворителях. Большинство из них имеют сладкий вкус, сильно гигроскопичны, легко образуют сиропы, из которых очень трудно бывает выделить моносахариды в кристаллическом виде. Растворы их нейтральны. Некоторые производные моносахаридов, содержащие карбоксильную группу, имеют кислый характер, аминосахара проявляют слабощелочные свойства. В организме человека и животных обнаружено более десятка различных моносахаридов. Преобладают среди них пентозы и гексозы. В 100 мл крови человека в покое содержится 70 – 100 мг глюкозы. Моносахариды с числом углеродных атомов больше семи в природе не встречаются, но в лаборатории были синтезированы молекулы, содержащие до девяти атомов углерода.
Изомерия моносахаров. (Самостоятельная работа студентов)
Оптическая изомерия моносахаридов. Характерной особенностью структуры моносахаридов является наличие в молекулах асимметрических (т.е. имеющих четыре различных заместителя) атомов углерода. Асимметрические атомы углерода представляют собой центры хиральности молекулы. Следствие хиральности молекулы — явление оптической изомерии, или энантиомерии, которое выражается в способности соединения вращать плоскость поляризованного света в противоположные стороны. Соединение с п асимметрическими атомами углерода может существовать в виде 2n изомеров. В соединениях с одинаковыми асимметрическими атомами углерода число оптических изомеров уменьшается вследствие существования мезо - форм. Мезо-соединения оптически неактивны из-за «внутренней компенсации» знака вращения. Примером мезо- соединения является D-ксилит. Оптические изомеры, относящиеся друг к другу как несимметричный предмет к своему зеркальному отображению, называют энантиомерами, или оптическими антиподами. Энантиомеры отличаются друг от друга конфигурацией всех центров хиральности и образуют правовращающую D-форму (лат. dexter— правый), или (+) - форму, и левовращающую L-форму (лат. laevus — левый), или (-) - форму, — стереохимические ряды моносахаридов. Изомеры, отличающиеся конфигурацией только части центров хиральности и не являющиеся оптическими антиподами, называют диастереомерами. Пару диастереомеров, отличающихся конфигурацией только одного асимметрического атома углерода, называют эпимерами. Э.Фишер и русский химик М. Розанов приписывали условно конфигурации D и L - глицеральдегиду; как показали дальнейшие экспериментальные исследования, эти предположения совпали с истинными конфигурациями. Таким образом,в качестве стандарта для определения принадлежности соединения стереохимическому D- или L-ряду была принята конфигурация асимметрического атома в простейшей триозе — D-глицериновом альдегиде (асимметрический атом углерода обозначен звездочкой):
Принадлежность соединения стереохимическому ряду определяет конфигурация асимметрического атома углерода с наибольшим номером (в случае глюкозы — атома С5). Если она совпадает с конфигурацией асимметрического атома углерода D-глицеринового альдегида, то соединение относят к D-ряду, если не совпадает — к L-ряду. В соответствии с R, S - номенклатурой D - конфигурация соответствует R - глицеральдегиду, a L - S- глицеральдегиду. Установлено, что все природные монозы относятся к D-ряду, однако среди них имеются как лево- (-), так правовращающие (+) соединения. Так D- глюкоза является правовращающим энантиомером, а D- фруктоза – левовращающим энантиомером.
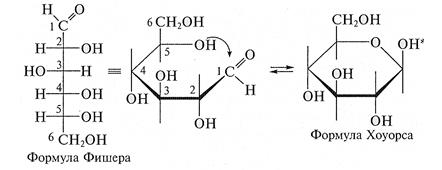
Цикло-оксо-таутомерия моносахаридов. Моносахариды могут существовать в циклической форме. Впервые предположение о циклическом строении глюкозы было высказано нашим соотечественником А.А. Колли (1870), а затем развито и дополнено немецким ученым Б. Толленсом (1883). За счет подвижности связей С-С пяти- и шестиуглеродные цепи углеводов могут иметь клешневидную конфигурацию и поэтому является возможным сближение двух функциональных групп - альдегидной (или кетонной) и гидроксильной групп у С4 или С5. За счет их внутримолекулярного взаимодействия друг с другом происходит замыкание цикла, и образуется циклическая структура углеводов (циклический полуацеталь). Образование циклических форм на примере глюкозы показано на ниже приведенной схеме:
Таким образом, образование полуацеталей можно рассматривать как внутримолекулярную реакцию AN, в результате которой образуются наиболее устойчивые шестичленные циклы (пиранозные) и пятичленные циклы (фуранозные). В твердом состоянии и в водном растворе моносахариды преимущественно существуют в виде циклических полуацеталей. Как показали исследования, в растворе устанавливается таутомерное равновесие между открытой (оксо-формой) и циклической формой моносахарида, причем циклическая форма значительно преобладает (более 99,9 % в равновесной смеси). Данный процесс схематически показан на примере фруктозы:
Для изображения на плоскости пространственной структуры соединений в открытой форме используют проекционные формулы Фишера, а для изображения на плоскости пространственной структуры циклических соединений применяют проекционные формулы Хоуорса (Хеуорса):
При этом руководствуются следующими правилами: цикл изображают плоским; заместители, находящиеся в оксо-форме справа, изображают под плоскостью цикла, а находящиеся слева — над плоскостью цикла; атомы водорода связей С—Н могут быть не показаны. В циклической форме появляется дополнительный по сравнению с открытой формой асимметрический атом углерода (центр хиральности): атом С1, в альдозах или атом С2 в кетозах, называемый аномерным атомом углерода, и дополнительная группа —ОН, называемая полуацеталъным гидроксилом (в формуле Хоуорса показана звездочкой *). Если конфигурация аномерного атома углерода совпадает с конфигурацией атома, определяющего принадлежность соединения стереохимическому ряду, его называют α-аномером, если не совпадает — β-аномером. Таким образом, α- и β-аномеры моноз можно рассматривать как изомеры положения полуацетального гидроксила. Переход аномерных форм α ↔ β осуществляется только через открытую оксо-форму: α-форма ↔ оксо-форма ↔ β-форма
Аналогично устанавливается равновесие в растворе между пиранозными и фуранозными формами. Преобладание α- или β-аномера зависит от природы монозы, растворителя, концентрации и других внешних условий. Равновесие между всеми формами является, таким образом, динамическим. Так, если какой-либо аномер глюкозы растворить в воде, он постепенно превращается в другой аномер, пока не образуется равновесная смесь двух аномеров, в которой также содержится очень небольшое количество открытой формы. Этот переход сопровождается изменением оптического вращения раствора. Такое явление называют мутаротацией (аномеризацией) моносахаридов. Равновесная смесь, образующаяся в результате мутаротации как α-, так и β-D-глюкопираноз, содержит 36 % a-изомера и 64 % β-формы. Доля оксо-формы в равновесной смеси невелика (при рН 6,9 равновесная смесь D-глюкозы содержит лишь малую часть альдегидной формы). Поэтому монозы не дают характерного для альдегидов окрашивания в реакции с фуксиносернистой кислотой и не реагируют с гидросульфитом натрия. Мутаротация катализируется кислотами и основаниями. В твердом состоянии монозы находятся исключительно в циклической форме. §9.1.3. Химические свойства моносахаридов.
В химическом отношении монозы сочетают в себе свойства многоатомных спиртов, карбонильных соединений и полуацеталей. 1. Образование гликозидов. Для циклических форм моноз наиболее характерны реакции с участием гидроксильной группы. Наиболее химически активна полуацетальная гидроксильная группа. Моносахариды взаимодействуют со спиртами с образованием О-гликозидов. Так, при пропускании через раствор β-D-глюкозы в этаноле газообразного хлороводорода происходит образование смеси α- и β-аномеров — этил-α,β-D-глюкопиранозы:
Молекула этанола выступает в данной реакции в роли нуклеофила. Аналогично монозы взаимодействуют с аминами и их производными с образованием N-гликозидов:
Гликозиды представляют собой продукты конденсации циклических форм моносахаридов со спиртами и аминами с образованием гликозидной связи. Гликозиды легко подвергаются гидролизу в кислой среде. По типу О-гликозидов образуются ди- и полисахариды, а по типу N-гликозидов— нуклеозиды — структурные компоненты нуклеиновых кислот. Гликозиды играют чрезвычайно важную роль в биохимических процессах, в частности в процессах дыхания и фотосинтеза. Важнейший из гликозидов — аденозинтрифосфат (АТФ), являющийся сложным эфиром фосфорной кислоты и аденозина — нуклеозида, являющегося продуктом конденсации аденина с рибозой. Фосфатные группы АТФ выполняют роль своеобразного энергетического депо; при их гидролизе выделяется энергия, необходимая клеткам для мышечного сокращения. Образование сложных эфиров. При взаимодействии с кислотами и их ангидридами монозы образуют сложные эфиры. Так, при взаимодействии глюкозы с уксусным ангидридом образуется пентаацетилглюкоза. Биологически важный пример реакции данного типа — реакция фосфорилирования глюкозы — ферментативное взаимодействие глюкозы с аденозинтрифосфорной кислотой с образованием глюкозо-6-фосфата:
Реакция происходит на первой стадии гликолиза (процесса окисления глюкозы в пируват). Необходимо заметить, что все промежуточные продукты гликолиза представляют собой сложные эфиры моноз и фосфорной кислоты. 2. Окисление моноз в кислой и нейтральной среде приводит к образованию различных кислот. Окислению может подвергаться: а) только карбонильная группа — «мягкое» окисление, например, бромной водой:
НО-СН2-(СНОН)n-СНО → НО-СН2-(СНОН)n— СООН Гликоновые кислоты б) карбонильная и первичная гидроксильная группы - «жесткое» окисление, например, раствором HNO3:
НО-СН2- (СНОН)n- СНО → НООС-СН2-(СНОН)n-СООН Гликаровые кислоты
в) только первичная гидроксильная группа в мягких условиях при защите альдегидной группы:
Гликурониды при нагревании легко декарбоксилируются, что приводит к образованию моноз с меньшим числом атомов углерода. Так можно получить из D-гликуронида пентозу — D-ксилозу. Окисление моноз в щелочной среде сопровождается деструкцией углеродного скелета. Реакции окисления характерны не только для альдоз, но и для кетоз (в отличие от кетонов), что объясняется явлением эпимеризации моноз (см. далее). Окислению могут подвергаться и некоторые дисахариды, называемые восстанавливающими. Существуя преимущественно в форме полуацеталей, они обладают потенциально свободной альдегидной группой (в оксо-форме). Восстанавливающие моно- и дисахариды восстанавливают ионы меди(II), входящие в состав комплекса с винной кислотой (С4Н606; H2tart) — реактив Фелинга [Cu(tart)2]2- или в состав комплекса с лимонной кислотой (C6H807; H3cit) — реактив Бенедикта [Cu(cit)]-, до оксида меди(I) Cu2O, а также ионы серебра в реактиве Толленса [Ag(NH3)2]OH до свободного серебра. Реакции используют как качественные на наличие восстанавливающих сахаридов.
3. Восстановление углеводов. Моносахариды подвергаются химическому либо билогическому восстановлению. Восстановление моноз, как и всяких карбонильных соединений, приводит к превращению карбонильных групп в спиртовые; при этом образуются многоатомные спирты, называемые сахарными спиртами, или альдитами:
Помимо амальгамы натрия в водной (или вводно - спиртовой, или спиртовой) среде для восстановления моноз используют водород в присутствии катализаторов (Pt, Pd, Ni) и гидриды металлов (особенно NaBH4). Следует иметь в виду, что при восстановлении альдоз образуется один спирт, а при восстановлении кетоз получают два стеоизомерных полиола:
При восстановлении D-ксилозы образуется D-ксилит:
4. Реакция изомеризации (эпимеризации) всегда происходит по α-СН*-кислотному центру моносахаридов, которым является атом углерода, непосредственно связанный с карбонильной группой. Реакция протекает под действием разбавленных растворов щелочей или ферментативно (в условиях организма) и сопровождается внутримолекулярным окислением — восстановлением (диспропорционированием) атомов углерода С, и С2. В ходе этой перегруппировки вследствие переноса протона, осуществляемого под влиянием гидроксильного иона, возникает промежуточное соединение - ендиол. Превращения ендиола могут привести к образованию как кетозы, так и двух альдоз. Таким образом, в результате реакции постепенно образуется равновесная смесь изомеров. Например, в результате эпимеризации D-глюкозы образуется D-манноза — эпимер глюкозы по С2 и D-фруктоза — структурный изомер глюкозы:
Пример реакции изомеризации в организме — ферментативное превращение глюкозо-6-фосфата в фруктозо-6-фосфат в процессе гликолиза.
§ 9.2. Производные моносахаридов (дезоксисахара и аминосахара) В природе встречаются моносахариды, у которых одна гидроксильная группа заменяется (чаще всего) на Н или NH2 - группу. Важную роль в биосистемах играет 2 - дезоксирибоза, входящая в состав ДНК.
Аминосахара образуются в случае, если при С2 - углеродном атоме ОН заменяется на NH2 - группу. Наиболее важными из них являются D(+) - глюкозамин и D(+) - галактозамин.
Глюкозамин Галактозамин
Олиго- и полисахариды. (Самостоятельня работа студентов.)
Продукты конденсации нескольких (от 2 до 12) молекул моносахаридов называют олигосахаридами; большего числа моносахаридов — полисахаридами. Дисахариды (биозы) представляют собой продукт конденсации двух молекул моносахаридов, соединенных О-гликозидной связью. Например, структурную формулу мальтозы, которая является основным продуктом расщепления крахмала в полости рта под действием фермента слюны — β-амилазы, можно представить следующим образом:
Систематическое название (4-(α-D-глюкопиранозидо)-D-глюкопираноза) указывает на наличие гликозидной связи между имеющим α-конфигурацию атомом C1 одного остатка глюкозы и атомом С4 другого остатка. Мальтоза ("солодовый сахар") образуется в результате конденсации двух молекул a-D-глюкопиранозы с образованием гликозидной связи между атомом C1 α-аномера глюкозы и атомом С4 второй молекулы глюкозы. Такую связь называют а(1→4)-связью. Благодаря сохранению у второго моносахарида свободного гликозидного гидроксила такие дисахариды способны к раскрытию цикла с воссозданием открытого таутомера с альдегидной группой, за счет чего они могут быть восстановителям (т.е. окисляться). Как альдозы они дают качественные реакции «серебряного зеркала» и образования красно - бурого осадка Cu2O. Дисахариды, как любые гликозиды, способны к гидролитическому расщеплению в кислой среде. Наиболее биологически важными дисахаридами являются сахароза, мальтоза, лактоза и целлобиоза. Сахарозу (α-D-глюкопиранозидо-β-D-фруктофуранозид) называют также тростниковым сахаром; она содержится в тростнике, сахарной свекле, различных фруктах, ягодах и овощах. Систематическое название сахарозы отражает и конфигурацию обоих гликозидных (суффикс «озид» у названий обеих моноз) гидроксилов (α или β), и наличие связи C1 —C2:
Растворы сахарозы не мутаротируют, не проявляют восстановительной способности и не реагируют с синильной кислотой. Это невосстанавливающий дисахарид. Лактоза (4-(β-D-галактопиранозидо)-D-глюкопираноза) имеет строение:
Целлобиоза (4-(β-D-глюкопиранозидо)-D-глюкопираноза) представляет собой основной структурный элемент целлюлозы; образуется при ферментативном гидролизе целлюлозы. Целлобиоза, как и лактоза, имеет 1,4-р-гликозидную связь и является восстанавливающим дисахаридом, но в отличие от лактозы при полном гидролизе дает только D-глюкозу:
Полисахариды. Если макромолекулы построены из остатков одного моносахарида, то такие полисахариды называют гомополисахаридами. Среди гомополисахаридов наиболее биологически важными являются поли-D-глюкопиранозы: амилоза, амилопектин, гликоген (дисахаридным фрагментом последних является мальтоза) и целлюлоза, структурным компонентом которой выступает дисахарид целлобиоза. Амилоза — это полимер неразветвленного строения (линейный полимер) молекулярной массой около 60 000; при нагревании растворяется в воде, образуя лиофильный коллоидный раствор; взаимодействует с йодом с образованием комплексного «соединения включения» синего цвета. Анализ методом светорассеяния и ультрацентрифугирования показал, что длина цепи молекулы амилозы часто достигает 6000 моносахаридных звеньев:
При ферментативном гидролизе β-амилазой, которая выделяется поджелудочной железой и содержится в слюне, амилоза расщепляется на глюкозу и мальтозу; гидролиз начинается с невосстанавливающего конца амилозы и осуществляется последовательным отщеплением молекул мальтозы. Амилопектин имеет разветвленную структуру и включает наряду с α(1→4)-связями и гликозидные α(1→6)-связи. За счет последних и образуются разветвления в структуре:
При растворении в воде амилопектин набухает, образуя связаннодисперсную систему — гель. С йодом амилопектин образует соединение красно-фиолетового цвета. Смесь амилозы (20 — 25%) и амилопектина (75 — 80%) представляет собой полисахарид природного происхождения — крахмал. Таким образом, природный крахмал не является индивидуальным веществом: он состоит их двух фракций, отличающихся по строению и вследствие этого обладающих различной растворимостью в теплой воде. Крахмал является основным резервным полисахаридом растений. Гликоген («животный крахмал») по структуре и свойствам похож на амилопектин, но имеет еще более разветвленную полимерную цепь и является резервным полисахаридом животных, запасаемым в печени и мускульной ткани. Гликоген является «двойником» крахмала в животном мире и играет роль депо питательных веществ и запасного углевода животных тканей. Одним из важнейших полисахаридов является целлюлоза. Она образует главную составную часть стенок растительных клеток. Целлюлоза представляет собой полимер, полностью состоящий из звеньев β -D-глюкопиранозы, которые связаны гликозидными β(1→4)-связями. Целлюлоза — линейный полимер, цепи которой могут содержать более 10 000 звеньев:
Чистая целлюлоза является белым волокнистым веществом, нерастворимым в воде, эфире или спирте. Такая устойчивость по отношению к растворителям объясняется уникальной структурой целлюлозы. Этот полисахарид состоит из остатков D-глюкозы, связанных только гликозидной β(1→4)-связью; молекулы целлюлозы нитевидные и не имеют разветвлений. Высокоупорядоченная структура, подтвержденная данными рентгеноструктурного анализа, обусловливает необычайную прочность и упругость целлюлозы, равно как и отсутствие растворимости в большинстве применяемых растворителей. Любопытно, что целлюлоза растворяется в реактиве, приготовленном смешиванием Сu(ОН)2 с концентрированным водным раствором аммиака (реактив Швейцера), а также в подкисленном растворе ZnCl2 при нагревании или в концентрированной серной кислоте, т. е. в тех средах, состав которых обусловливает возможность разрыва водородных связей в молекулах целлюлозы и образование новых связей с растворителем. Благодаря наличию свободных спиртовых гидроксильных групп целлюлоза способна реагировать со спиртами и кислотами с образованием эфиров. Целлюлоза выполняет функции структурного полисахарида, используемого организмом для построения остова клеточной ткани. Гетерополисахариды (Самостоятельная работа студентов).
Молекула гетерополисахарида состоит из остатков различных моносахаридов. Наиболее важную роль в организмах играют гиалуроновоя кислота и гепарин. Гиалуроновая кислота –важнейшая составная часть межклеточного вещества тканей животных и человека. Особенно много ее содержат кожа, сухожилия, стекловидное тело глаза и т. п. Этому полисахариду свойственны многие разнообразные функции. Так, гиалуроновая кислота выполняет роль смазки, поэтому ее много в сухожилиях, коже и хрящах. Высокие вязкость и липкость этого углевода делают его важным барьером на пути микроорганизмов, проникающих внутрь соединительной ткани. Этот барьер способны разрушать патогенные для человека и животных микроорганизмы. Для этой цели у них есть особый фермент – гиалуронидаза, расщепляющий гиалуроновую кислоту. В то же время фермент гиалуронидаза, синтезируемый организмом животного или человека, регулирует обмен гиалуроновой кислоты в тканях и, таким образом, существенно влияет на транспорт веществ в системе "клетка – межклеточное пространство". В организме животного и человека этот полисахарид обычно находится в связанном с белками состоянии. Комплекс гиалуроновой кислоты с белком, называемый протеогликином, способен обратимо связывать Na+, K+ и Са2+ и тем самым регулировать процесс обмена этих ионов.
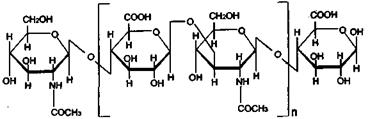
Молекулярная масса гиалуроновой кислоты варьирует от 270 000 до 500 000. Являясь гетерополисахаридом, этот углевод содержит два различных структурных компонента – N-ацетил-β-D-глюкозамин (элементарную единицу хитина) и глюкуроновую кислоту, продукт окисления глюкозы. Между собой эти фрагменты соединены гликозидными связями С1—О—С4 и С1—О—С3: Гепарин –гетерополисахарид, который можно обнаружить в малых количествах в различных тканях организма животного и человека – в печени, крови, легких, селезенке и др. Главная функция гепарина – предотвращение свертывания крови. В частности он прекращает действие тромбина и подавляет образование фибрина из фибриногена. В качестве антикоагулянта (от греч. anti – против, лат. coagulatio – свертывание, затвердение) гепарин широко применяют в медицине и ветеринарии как лекарственное средство для предупреждения образования тромбов в сосудах.
Молекулярная масса гепарина колеблется от 10 000 до 15 000. Он состоит из двух компонентов – остатков глюкуроновой кислоты и а-глюкозамина в виде производных серной кислоты: Агар-агар – высокомолекулярный полисахарид, содержащийся в некоторых морских водорослях. В Российской Федерации агар-агар добывают из багряной водоросли анфелъции, произрастающей в Белом, Баренцевом и Балтийском морях, а также на Дальнем Востоке. В холодной воде агар-агар нерастворим, но растворяется в ней при нагревании. Водные растворы агар-агара при охлаждении застывают в виде студня. Благодаря этим свойствам агар-агар, наряду с желатином, используют в микробиологии для приготовления твердых питательных сред при культивировании бактерий и грибов. Агаризированные питательные среды прозрачны, что позволяет наблюдать особенности роста и развития колоний микроорганизмов не только на поверхности, но и в глубине питательного субстрата. Находит применение агар-агар и в кондитерском производстве для приготовления желе, пастилы, мармелада, джемов. Агар-агар представляет собой смесь двух полисахаридов – агарозы и агаропектина. Основными структурными элементами этих углеводов служат уже знакомые нам галактопираноза и глюкуроновая кислота, а также сульфоэфиры этих моносахаридов.
|
|||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 697; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.167.85 (0.017 с.) |