Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химические свойства предельных кислот и их производныхСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
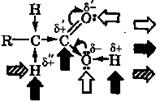
Для карбоновых кислот и их производных характерна разнообразная реакционная способность, обусловленная присутствием в молекулах карбоксильной группы. В карбоксильной группе имеются полярные ковалентные связи: между ее углеродным и кислородным атомами (С=О, С—О), а также связь О—Н. При этом связь С=О длиннее, чем в кетонах, а связь С—О короче, чем в спиртах, что обусловлено взаимодействием неподеленной пары кислородного атома гидроксильной группы с л-электронами карбонильной группы, т. е. электронодопорным эффектом сопряжения (+М). В результате этого эффекта увеличивается полярность связи О—Н и снижается частичный положительный заряд δ+ на карбонильном углеродном атоме по сравнению с другими карбонильными соединениями (альдегидами и кетонами).
Соответственно и связанный с карбоксильной группой С—Н - кислотный центр является более слабым, чем аналогичный центр в альдегидах и кетонах:
– нуклеофильный центр (атакуется электрофилом) – электрофильный центр (атакуется нуклеофилом)
– подвижный атом водорода (атакуется свободным радикалом)
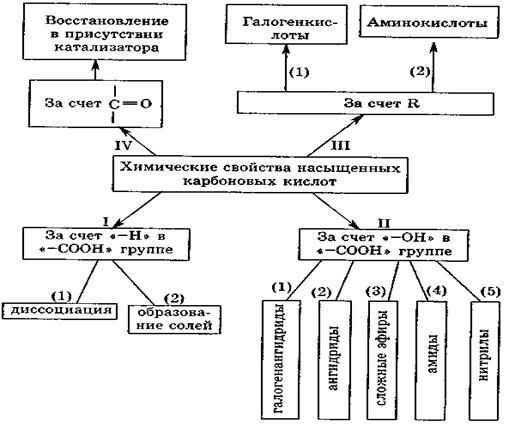
В отличие от альдегидов и кетонов, для которых характерны реакции нуклеофильного присоединения по кратной связи карбонильной группы, карбоновые кислоты и их производные обычно вступают в реакции нуклеофильного замещения по их элек-трофильным центрам, часто сопровождаемые кислотно-основными и окислительно-восстановительными превращениями. Атом водорода, связанный с α-углеродным атомом цепи, также чувствителен к атаке свободными радикалами, что может приводить к гомолитическому разрыву разных связей и даже вызывать реакции декарбоксилирования или декарбонилирования (отщепления СО2 или СО соответственно). Таким образом, карбоновые кислоты и их производные могут взаимодействовать с нуклеофилами, электрофилами или с радикальными частицами в зависимости от свойств реагентов и условий проведения реакции. Схема, отражающая химические свойства насыщенных монокарбоновых кислот приведена ниже.
Кислотно-основные свойства.
Карбоновые кислоты вследствие большой полярности и поляризуемости связи О—Н проявляют кислотные свойства, что отражается в их названии. В водных растворах происходит диссоциация этой связи с образованием гидратированных частиц: протона и аниона, называемого карбоксилат-анионом:
В карбоксилат-анионе отрицательный заряд равномерно распределяется между обоими кислородными атомами из-за делокализации электронной плотности в сопряженной системе, что увеличивает стабильность этой частицы. Сила карбоновых кислот зависит от природы заместителей в углеводородном радикале и от стабильности образующегося аниона. Так, электронодонорные заместители (+ I -эффект) ослабляют кислотные свойства, потому что уменьшают частичный положительный заряд на углеродном атоме карбоксильной группы (ср. рКа НСООН и СН3СООН). Электроноакцепторные заместители (- I -эффект), оттягивая на себя электронную плотность, способствуют усилению кислотности карбоновых кислот, так как одновременно увеличивают частичный положительный заряд на углеродном атоме карбоксильной группы и стабилизируют карбоксилат-анион из-за большей делокализации отрицательного заряда:
СН3СООН НСООН СlСН2СООН O2NCH2COOH С12СНСООН С13ССООН рК a 4,7 3,75 2,85 1,7 1,25 0,66 ——————————————————————→ увеличение кислотности
Карбоновые кислоты являются более сильными кислотами (рКа = 4,0÷5,0), чем угольная кислота (рКа = 6,3). Поэтому с их помощью можно выделять угольную кислоту (практически СО2) из карбонатов: Na2CO3 + 2СН3СООН → 2CH3COONa + Н2О + CО 2↓ Реакции нейтрализации и гидролиза солей. Под действием щелочей карбоновые кислоты вступают в реакцию нейтрализации: RCOOH + NaOH <=> RCOONa + Н2О В щелочной среде равновесие сильно смещено в направлении продуктов. Обратная реакция, т.е. гидролиз солей карбоновых кислот, проявляется в водных растворах солей и приводит к частичному образованию этих относительно слабых кислот и к повышению рН раствора (рН > 7). Смеси карбоновых кислот с их солями образуют буферные системы.
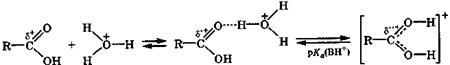
Основные свойства. В кислой среде (рН < 2) диссоциация незамещенных карбоновых кислот практически не происходит, но образуются их ассоциаты с катионом гидроксония по карбонильному кислородному атому за счет достаточно прочной водородной связи. При очень сильном увеличении кислотности среды такой ассоциат превращается в катион карбоновой кислоты:
δ+< δ'+< δ''+ ассоциат катион с водородной связью карбоновой кислоты
Основность карбоновых кислот [рКа(ВН+) ≈ -6] сравнима с основностью кетонов, но значительно ниже основности спиртов или простых эфиров [рКа(ВН+) ≈ -2...-4]. В растворе 70 % серной кислоты будет протонировано около 50 % молекул карбоновой кислоты. Образование ассоциата с водородной связью и особенно катиона карбоновой кислоты приводит к значительному увеличению положительного заряда на карбонильном атоме углерода и повышает его электрофильную активность в реакциях нуклеофильного замещения группировки ОН карбонильной группы.
|
|||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 443; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.21.237 (0.007 с.) |