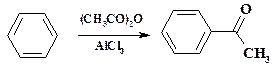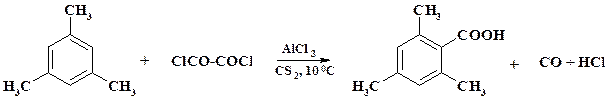Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реакции гидроксиалкилированияСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Реакции гидроксиалкилирования нашли широкое применение в производстве мономеров, полимеров, а также триарилметановых красителей. В общем виде взаимодействие альдегида или кетона с ареном представлено на следующей схеме:
Атакующей электрофильной частицей является карбокатион. Его образование наблюдается при протонировании атома кислорода карбонильной группы альдегида или кетона:
На первой стадии реакции получается бензиловый спирт, который на второй стадии легко дает новый карбокатион, атакующий вторую молекулу арена, при этом образуется диарилметан. В качестве антисептического средства для наружного применения используют бриллиантовый зеленый, синтез которого представлен на схеме:
При взаимодействии бензальдегида с диэтиланилином в присутствии серной кислоты образуется бесцветное лейкосоединение, окисление которого с переводом основания в оксалат дает краситель. Реакция бензальдегида в тех же условиях с диметиланилином приводит к получению красителя малахитовый зеленый. Из бензальдегида и фенола получают гидрокситриарилметановый краситель – фуксин, который также обладает антисептическими свойствами и используется для наружного применения. Из пиридин-2-аля и фенола с последующим ацилированием лейкооснования уксусным ангидридом синтезируют препарат бисакодил, обладающий слабительным действием. Наиболее крупнотоннажным производством (более 2 млн т), в котором используется реакция гидроксиметилирования, является получение фенолформальдегидных смол. Поликонденсацией фенола и формалина в щелочной среде получают резолы (термореактивные смолы), которые отверждаются при нагревании, давая сетчатый полимер:
Также крупнотоннажным продуктом (более ста тысяч тонн) является мономер для получения эпоксидных смол дифенилолпропан (диан). Это соединение получают реакцией фенола и ацетона в присутствии смолы КУ-2 при 90 оС:
В качестве промежуточного продукта в синтезе полиуретанов используют ди-(4-аминофенил)метан. Реакцию ведут в присутствии HCl при 70 – 100 оС.
Реакции хлоралкилирования
Введение в ароматическое ядро a-хлоралкильных остатков называют реакциями хлоралкилирования. Наибольшее значение имеет реакция хлорметилирования.
Реагенты. В отдельных случаях используют водный раствор формальдегида – формалин. Лучшие результаты получены при использовании тримера формальдегида – триоксана или параформа с невысокой молекулярной массой.
Кроме того, в этой реакции могут быть использованы хлорметиловый и дихлорметиловый эфир – ClCH2OCH3 , ClCH2OCH2Cl.
Катализаторы. В качестве катализаторов используют кислоты Льюиса – ZnCl2, AlCl3. Чаще всего сухой HCl является и реагентом и катализатором. Реакции, как правило, ведут в апротонных растворителях – дихлорэтане, хлорбензоле или трихлорэтилене.
Механизм реакции. Так же как и при гидроксиметилировании, в две стадии образуется бензильный карбокатион. Однако при наличии анионов хлора быстро происходит образование хлорметильных производных. Эти процессы представлены на следующей схеме:
В отличие от реакций С-алкилирования, чувствительность к влиянию заместителей существенно выше (r = - 5). Введение хлорметильной группы, обладающей слабыми электроноакцепторными свойствами, приводит к большей региоселективности этой реакции. К крупнотоннажным производствам относится получение хлорметилированного полистирола, который используют в качестве промежуточного продукта в синтезе анионитов. Реакцию проводят в растворе полистирола и параформа в дихлорэтане. Пропускают ток сухого хлороводорода, полученный продукт направляют на промывку и далее на взаимодействие с аминами. В медицинской промышленности реакция хлорметилирования используется при получении препаратов папаверин и дротаверин (но-шпа). Вератрол (в случае папаверина) или о- диэтоксибензол растворяют в дихлорэтане или трихлорэтилене, добавляют параформ и пропускают ток сухого HCl. Для предотвращения образования производных дифенилметана избыток хлороводорода должен быть не менее 3 молей.
Процесс ведут при температуре 40 – 50 оС, т. к. в результате реакции выделяется вода, используют эмалированную аппаратуру. Полученный продукт обладает лакриматорными свойствами, потому его направляют без выделения на стадию цианирования.
Реакции аминоалкилирования
Механизм реакции аминоалкилирования является обычным для введения углеродных остатков в ароматический цикл. Образование карбокатиона происходит за счет присоединения амина к формальдегиду:
Подобно формальдегиду реагируют и другие алифатические и ароматические альдегиды. Помимо ароматических соединений в реакции вступают СН-кислоты и кетоны. К превращениям данного типа относятся реакции Манниха, Айнхорна и Бетти. Препарат феникаберан обладает спазмолитическим, антиаритмическим действием, используется для лечения хронической коронарной недостаточности с приступами стенокардии. В синтезе данного лекарственного средства введение диметиламинометильной группы осуществляют с помощью реакции Манниха:
Синтез исходного гидроксибензоксазола приведен в разделе 2.7.
Реакции С-ацилирования
Одной из широко распространенных реакций электрофильного замещения в ряду ароматических соединений являются реакции С-ацилирования. При этом образуются арилкетоны. Реагентами служат те соединения, которые под действием катализатора могут генерировать ацильный карбокатион.
Реагенты. R-COCl, (RCO)2O, RCOOAlk, RCOOH, R-CN, Hal-CN. Реакционная способность тем выше, чем больше положительный заряд на атоме углерода: R-COHal > (RCO)2O > RCOOAlk > RCOOH > RCONH2
В случае использования галогенангидридов наиболее активными являются бромангидриды кислот: RCOF < RCOCl < RCOBr. Катализаторы те же, что и при алкилировании, но в основном кислоты Льюиса. Для малореакционноспособных соединений применяют Al2Cl6, т. к. его реакционная способность высокая. Для высокореакционноспособных субстратов могут быть использованы ZnCl2, FeCl3.
Механизм реакции. В апротонных растворителях с помощью ИК и ЯМР спектроскопии было зафиксировано образование карбокатиона в виде тесной ионной пары:
Образование карбокатиона (иона ацилия) облегчено по сравнению с другими реакциями этого типа. Но его реакционная способность ниже, чем в случае применения Alk+ AlX4-. Электрофильная атака активированного реагента на ароматический цикл обычна для реакций электрофильного замещения:
Однако конечный продукт остается связанным с катализатором, разложение комплекса осуществляют с помощью добавления воды. Таким образом, катализатор не регенерируется. При использовании ангидридов, катализатор связывается и с кислотой. Поэтому необходимо использовать 1 или 2 – 2,5 мол катализатора. Кинетическое уравнение процесса имеет следующий вид:
V= Ко бщ [ArH][R-COX][AlCl3] V= К общ [ArH][(R-COO)2O][AlCl3]2
В отличие от реакции алкилирования, чувствительность реакции к действию заместителей существенно выше, r = -7…-9,5 (для алкилирования r = -2.. -3), т. е. реакции С-ацилирования существенно более региоселективны. Кроме того, введение ацильной группы в ядро приводит к снижению реакционной способности полученного соединения по сравнению с исходным субстратом sCOR > 0. Так для COCH3 s+n = + 0,5, sm = + 0,38. Реакции имеют строгую стадийность, а также, в отличие от алкилирования, не наблюдается изомеризация алкильного остатка. Потому, при необходимости введения в молекулу целевого продукта алкильной группы, целесообразнее получить соответствующий кетон и затем восстановить его до алкильного производного. Наиболее крупнотоннажным производством является получение антрахинона и большого ряда его производных (красителей). Реакцию с фталевым ангидридом ведут в избытке бензола, являющегося растворителем и реагентом. Если после окончания процесса проводят разложение реакционной массы водой, то получают 2-карбоксибензофенон (бензоилбензойную кислоту), нагревание которого в серной кислоте приводит к циклизации и образованию антрахинона. Повышение температуры после завершения первой стадии реакции ацилирования дает непосредственно антрахинон. Разработан также способ непрерывного проведения процесса в газовой фазе при 400 оС на гетерогенном катализаторе, в качестве которого используют силикат цинка. Полученные пары антрахинона и воды охлаждают и отделяют целевой продукт.
Реакцией фталевого ангидрида с гидрохиноном в плаве AlCl3 – NaCl при 170 оС получают 1,4-дигидроксиантрахинон – краситель хинизарин.
При использовании высокореакционноспособного субстрата ацилирования, каким является фенол, катализатором может служить хлорид цинка.
Реакция не останавливается на первой стадии. Полученный кетон также дает карбокатион и реагирует с фенолом. Образующийся триарилгидроксиметан дает лактон – бесцветную форму фенолфталеина (биологическую активность см. раздел 2.1.5). При добавлении щелочи лактонный цикл раскрывается и образуется хиноидная форма, имеющая в растворе красный цвет. При внесении в плав резорцина и фталевого ангидрида безводного хлорида цинка при температуре 105 оС происходит аналогичная реакция. При повышении температуры реакционной массы до 170 – 195 оС продукт дает ксантеновый цикл:
Натриевая соль полученного красителя флюоресцеина в водных растворах дает зеленую флюоресценцию при разбавлении 1:40 000 000. Это свойство используют для слежения за движением воды, для денатурации спирта и для ангиодиагностики. Тетрабромпроизводное – эозин – применяется в цитологии для окрашивания срезов биологических тканей. При проведении реакции фталевого ангидрида с м -диэтиламинофенолом получают ксантеновое производное – роданин, который служит пищевым красителем. Промежуточным продуктом в производстве кристаллического фиолетового является кетон Михлера – 4,4΄-бисдиметиламинобензофенон. Это соединение получают из диметиланилина и фосгена:
Модификациями ацилирования являются реакция Неницеску и перегруппировка Фриса. Метод Неницеску – ацилирование фенолов карбоновыми кислотами в присутствии хлорида цинка. Метод Фриса – перегруппировка О-ацильных эфиров фенолов в о - и п -ацилфенолы в присутствии хлорида алюминия, как это отражено на схеме.
Одним из продуктов, производимых промышленностью, является ацетофенон, который используют в качестве растворителя и промежуточного продукта, в частности при производстве фенилэфрина (мезатона). Это соединение является и побочным продуктом при многотоннажном производстве фенола из кумола (см. раздел 2.6).
Бензофенон, как уже отмечалось, получают из бензола и четыреххлористого углерода. Его синтез из бензола и бензоилхлорида или фосгена менее рентабелен. В производстве нейролептиков, таких как трифлуперидол, галоперидол (формула галоперидола приведена на схеме, типичный синтез на примере трифлуперидола приведен в разделе 2.2), трифлуспирилен и др. используют реакцию С-ацилирования. Большая группа нейролептиков является производными бутирофенона. На схеме представлен фрагмент синтеза одного из них – галоперидола:
Ацилирование фторбензола хлорангидридом g-хлормасляной кислоты или бутиролактоном дает п -фторфенил-g-гидрокси(хлор)бутирофенон. Образующийся спирт или галогеналкил в выбранных условиях не алкилирует молекулу фторбензола. Однако при двукратном мольном количестве фторбензола и хлорида алюминия бутирофенон реагирует по кетонной группе, давая производные 4,4-бис-(п- фторфенил)бутиленгликоля, из которых получают препараты пенфлюридол и флуспирилен. Для дальнейшего синтеза галоперидола гидроксигруппу замещают на хлор с помощью тионилхлорида. Полный синтез и биологическое действие этой группы лекарственных средств приведены в разделе 2.3.
Технологические аспекты проведения процессов ацилирования. Реакцию проводят в среде органического растворителя, которым может быть избыток ArH или другие соединения, не вступающие в реакцию. Аппаратура – эмалированный аппарат, снабженный рубашкой для обогрева паром и охлаждения. Температурный режим обычно 80 – 120 оС, контроль процесса – по скорости выделения HCl. Для выделения продукта реакционную массу, как правило, выливают на подкисленную воду. Хлорид алюминия растворяется в воде, органический слой отделяют на делительной воронке. Отделение от растворителя осуществляют фракционной вакуум-перегонкой либо отгонкой с паром, в зависимости от свойств продукта.
Реакции С-формилирования
Одной из непростых задач тонкого органического синтеза является получение альдегидов. Их синтез частично рассмотрен в разделах 2.5 и 2.6. Для получения альдегидов ароматического и гетероциклического ряда используют реакции формилирования, которые являются частным случаем реакций С-ацилирования. Однако хлорангидрид муравьиной кислоты не существует в обычных условиях, т. к. разлагается до СО и HCl. Тем не менее взаимодействие монооксида углерода и сухого хлористого водорода или СО и HF в присутствии BF3 дает в незначительных концентрациях галогенангидрид и позволяет провести реакцию формилирования.
Реакция Гаттермана-Коха находит промышленное применение для получения простых ароматических альдегидов:
В жидкий ароматический углеводород пропускают смесь сухого HCl и СО. Роль дихлорида меди заключается в том, что это соединение дает нестойкий комплекс с СО и связывает его в растворе. Этим способом, в частности, синтезируют п -толуиловый альдегид. Для получения альдегидов, содержащих электронодонорные группировки, используют реакции Гаттермана и Вильсмайера. Так синтез анисового альдегида ведут при 40 – 60 оС, пропуская сухой HCl в смесь бензола и анизола, содержащую цианид цинка и хлористый алюминий. При добавлении воды и кипячении реакционной массы получают альдегид с выходом 90 %.
Широко применяемым методом введения альдегидной группы в активированное ароматическое ядро является реакция Вильсмайера. Данный способ заключается в том, что формамиды под действием оксотрихлорида фосфора, хлористого тионила или фосгена дают иммониевый катион, наличие которого доказано спектрами ЯМР. Образующийся иммониевый катион атакует молекулу ароматического соединения с образованием s-аддукта, который быстро превращается в имин. Гидролиз полученного промежуточного соединения приводит к альдегиду. Реакция региоселективна (r = - 8,7), и обычно образуется один изомер.
Способ используется для получения п- диалкиламинобензальдегидов. Образуются только п -изомеры, выход составляет около 90 %. Синтез препарата противоопухолевого препарата сарколизин с использованием реакции Вильсмайера приведен на схеме:
Метод получения сарколизина разработан на кафедре технологии органического синтеза УПИ (В.Н. Конюхов, З.В. Пушкарева, Ф.А. Абезгауз). Реакция бисгидроксиэтиланилина с оксотрихлоридом фосфора в диметилформамиде дает п- бис(b-хлорэтил)аминобензальдегид. Одновременно протекают реакция Вильсмайера и замена гидроксигрупп на хлор. Полученное соединение конденсируют с гиппуровой кислотой, образовавшийся азлактон восстанавливают и бензоильную защиту удаляют нагреванием в соляной кислоте. Способ прост и безопасен. Первоначально использованный на заводе «Фармакон» способ синтеза сарколизина был снят с производства в связи с высокой токсичностью применяющегося в качестве промежуточного продукта п- нит-робензилбромида. Более эффективным является L -изомер – препарат мелфалан, который получают из L -фенилаланина. Синтез салицилового альдегида проводят восстановлением натриевой соли салициловой кислоты амальгамой магния в водном растворе, выделяют с помощью образования азометина с п -толуидином. Однако более удобным способом получения является взаимодействие образовавшегося в щелочной среде из хлороформа дихлоркарбена с фенолятом натрия:
Реакция осуществляется довольно просто и, хотя выход составляет 50 %, находит практическое применение.
Реакция карбоксилирования
Прямое введение карбоксигруппы в ароматическое ядро (реакция Кольбе – Шмидта) имеет большие ограничения по структуре реагирующего субстрата, однако используется в медицинской промышленности. В отличие от других реакций электрофильного замещения, СО2 – очень слабый электрофил, не способный реагировать с ароматическими углеводородами. И только в случае фенолятов, обладающих очень высокой реакционной способностью, удается в приемлемых технологических условиях получить карбоксипроизводные. Важнейшим производством с использованием реакции карбоксилирования является синтез салициловой кислоты:
При взаимодействии сухого феноксида натрия при температуре 170 – 180 оС и давлении СО2 0,4 – 0,6 МПа образуется натриевая соль салициловой кислоты. Ориентацию в о- положение можно объяснить тем, что происходит стабилизация s-аддукта. При использовании солей К+, Rb+ или Cs+, имеющих больший ионный радиус, чем натрий, образование такого комплекса из-за пространственных помех невозможно и образуется п- гидроксибензойная кислота. Это же соединение получают и при проведении реакции при температуре 250 оС. Данный изомер термодинамически более выгоден (термодинамический контроль реакции). При наличии в молекуле двух гидроксигрупп (резорцин) или амино- и гидроксигруппы реакция идет уже в воде при температуре 100 оС:
Этим способом получают п- аминосалициловую кислоту (ПАСК), которая является противотуберкулезным препаратом.
Технология. Растворяют в автоклаве фенол в конц. NaOH, упаривают раствор и дополнительно высушивают фенолят натрия. Затем начинают подавать под давлением СО2 и повышают температуру до 180 оС. Нагревание автоклава осуществляют подачей высокотемпературного пара в «мятую» рубашку или с помощью электрообогрева. Перемешивание сухого феноксида натрия осуществляют с помощью мощной ножевой (гребковой) мешалки. Реакцию ведут до полного расхода фенолята натрия. Реакционную массу охлаждают и растворяют в воде. Водный раствор передают в аппарат и подкисляют водным раствором HCl. Продукт отфильтровывают и для очистки проводят его сублимацию. Синтез производных бензойной кислоты возможен также с помощью реакции арена с оксалилхлоридом:
Препаративное значение для получения карбоновых кислот имеет реакция литий- или магнийорганических соединений с углекислым газом. Декарбоксилирование является обратной реакцией карбоксилирования и широко используется в органическом синтезе.
|
||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 909; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.11.13 (0.009 с.) |