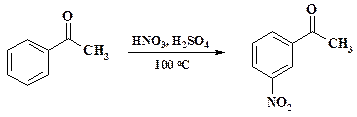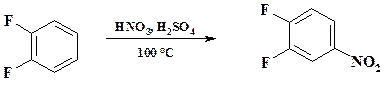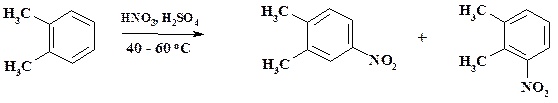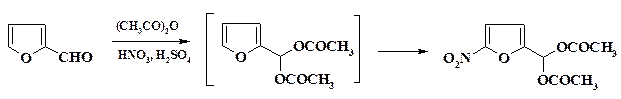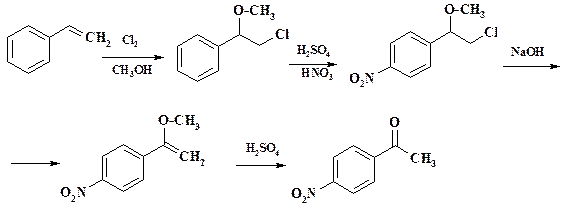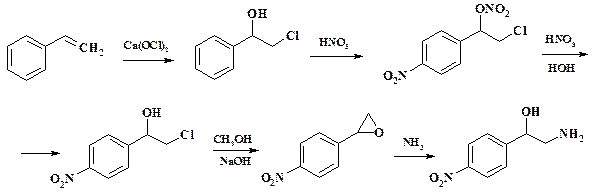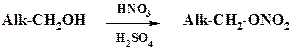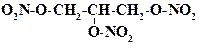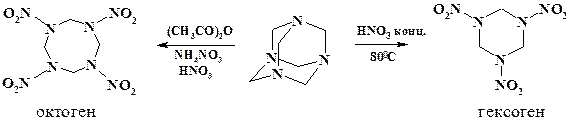Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Для получения полупродуктов и лекарственных средствСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Как уже неоднократно отмечалось, реакции нитрования широко используются как в основном органическом синтезе, так и в медицинской промышленности. Далее будут рассмотрены основные производства.
Получение крупнотоннажных продуктов. Наиболее крупнотоннажными производствами являются получение нитробензола (около 2 000 т), нитротолуолов, динитротолуолов и тринитротолуола, а также о- и п- нитрохлор-бензолов и динитрохлорбензола. Производство этих соединений осуществляют непрерывным методом в одном аппарате или каскаде реакторов. Реакцию нитрования бензола проводят в нитраторе непрерывного действия, который может быть трубчатым или обычным емкостным аппаратом со змеевиком для дополнительного охлаждения. Трубчатый реактор является кожухотрубным теплообменником с плоской крышкой. В сферическом днище имеется кран для непрерывной подачи нитрующей смеси. Реакция идет в трубах. Бензол подают сверху в центральную трубу, где работает многоярусная пропеллерная мешалка, направляющая его к днищу аппарата. Через верхний штуцер аппарата непрерывно отводится нитробензол и отработанная кислота. Хладагент подают в межтрубное пространство для поддержания температуры в пределах 40 – 50 оС. В емкостном реакторе с рубашкой и змеевиком, который выполняет функцию диффузора, подача нитрующей смеси и бензола осуществляется в верхнюю часть внутреннего пространства диффузора, где также работает многоярусная пропеллерная мешалка, направляющая реакционную массу к днищу и далее к стенке аппарата. Вывод реакционной массы осуществляется через верхний штуцер. Подача нитрующей смеси и бензола осуществляется с помощью мерников непрерывного действия. Реакционную массу, вытекающую из нитратора, насосом передают в кожухотрубные холодильники, в которых она охлаждается до 20 – 25 оС. Из холодильников смесь поступает в сепаратор непрерывного действия, где разделяются нитробензол и отработанная кислота, которые поступают в соответствующие сборники. В отработанной кислоте содержится до 16 % нитробензола, который экстрагируют бензолом. Фазу, содержащую бензол и нитробензол, возвращают через сборник в нитратор. Отработанную кислоту направляют для денитрации – удаления оксидов азота и оставшейся азотной кислоты. Ее нагревают до 110 – 120 оС и затем продувают горячим воздухом. Для нитрования 1 т бензола готовят нитрующую смесь из 63 % азотной кислоты и 96 % серной, при этом образуется около 3,5 т отработанной 75 % серной кислоты. Часть ее используют для приготовления нитрующей смеси из меланжа и 18 – 20 % олеума. Однако и в этом случае остается неизрасходованной около 1,2 т отработанной кислоты, не находящей сбыта, что является серьезной экологической проблемой. Экономически целесообразно совмещение производств нитробензола и серной кислоты на одном предприятии. Разработан процесс с азеотропной отгонкой воды. Бензол и вода дают азеотропную смесь. Используют большое количество бензола, при температуре 120 оС происходит отгонка бензола, воды и азотной кислоты, серная кислота не разбавляется. Однако качество полученного нитробензола ниже. Имеются патентные данные (ФРГ) о нитровании бензола 65 % азотной кислотой, в этом процессе также не возникает проблема с утилизацией отработанной серной кислоты. Полученный нитробензол промывают водой и содой для удаления растворенной кислоты и примесей нитрофенолов. Затем перегоняют в вакууме для отделения от примесей динитробензола, который опасен при парофазном гидрировании в производстве анилина, т. к. это взрывоопасное соединение накапливается в испарителе. Аналогично ведут мононитрование толуола и хлорбензола. Однако, в отличие от получения нитробензола, в реакции образуется смесь изомеров. Для их разделения существует сложная технологическая схема, включающая ректификацию и кристаллизацию. Подробно технология рассмотрена во многих учебниках.
Реакции нитрования при получении лекарственных препаратов. Проведение нитрования при получении лекарственных средств осуществляется всегда периодическим способом, т. к. тоннаж производства невелик. Препарат фенилэфрин (мезатон) обладает адреномиметическим действием, активность рассмотрена в разделе 1.2. Первой стадией получения мезатона является нитрование ацетофенона. Нитрогруппа на последних стадиях синтеза восстанавливается, затем проводят диазотирование и замену диазониевой группы на гидроксигруппу. Эти реакции и полный синтез препарата будут рассмотрены в следующих разделах.
Нитрование ведут в обычном емкостном аппарате. Нитрующую смесь готовят из меланжа и 96 % серной кислоты, используют 10 % избыток азотной кислоты по сравнению с расчетным количеством. Температура реакции 90 – 100 оС. Предварительно приготовленную нитрующую смесь через мерник прибавляют к нагретому до 40 – 50 оС ацетофенону, по достижении 70 оС включают охлаждение. После прибавления всей нитрующей смеси и понижении температуры охлаждение отключают и пуском пара в рубашку реакционную массу подогревают в течение часа до 100 – 110 оС. Сливанием реакционной массы в охлажденную воду выделяют м -нитроацетофенон. Выпавший осадок отфильтровывают, промывают водой и раствором соды. Примеси о- и п- изомеров вместе с частично растворенным целевым продуктом остаются в фильтрате. Разбавленную смесь серной и азотной кислот направляют на станцию нейтрализации и далее на биоочистку. В синтезе препарата пефлоксацин (см. раздел 2.3) промежуточным продуктом является дифторнитробензол, который получают нитрованием дифторбензола в смеси конц. серной и 63 % азотной кислоты при 100 оС.
После завершения процесса реакционную массу выливают на охлажденную воду, нитросоединение отделяют и промывают водой. Целевой продукт очищают перегонкой в вакууме. В аналогичных условиях ведут нитрование и о- ксилола при получении полупродуктов в синтезе мефенаминовой кислоты и рибофлавина. Разделение изомеров проводят с помощью ректификации. Синтез рибофлавина из нитроксилола более рентабелен, чем из бромбензола.
Нитрофурановые препараты получают из нитрофурфурола или 5-нит-рофурфуролдиацетата. Нитрование фурфурола ведут нитрующей смесью в смеси уксусного ангидрида и уксусной кислоты.
Процесс ведут в емкостном аппарате со змеевиком. Вначале готовят смесь уксусного ангидрида и ледяной уксусной кислоты, к ней через мерник при температуре от минус 3 оС до 0 оС медленно прибавляют приготовленную в отдельном аппарате нитрующую смесь так, чтобы температура не повышалась выше 10 – 15 оС. Нитрующую смесь готовят из меланжа и 94 – 96 % серной кислоты. При охлаждении рассолом из мерника прибавляют фурфурол с такой скоростью, чтобы температура не повышалась выше 5 оС. Полученный диацетат нитрофурфурола находится в растворе. Реакционную массу выливают на воду, охлаждают до 10 оС и нейтрализуют раствором NaOH. Осадок 5-нитрофурфуролдиацетата промывают на фильтре водой. Последний может быть непосредственно использован для получения фуразолидона и фуразонала. Для получения фурацилина диацетат превращают в нитрофурфурол. Одной из первых стадий синтеза хлорамфеникола (левомицетина) является нитрование метилового эфира хлоргидрина стирола.
Процесс ведут в емкостном аппарате при температуре 20 – 30 оС. Нитрующую смесь готовят из меланжа и 96 % серной кислоты. При этом практически не образуется о- и м- изомеров. Использование вместо меланжа 63 % азотной кислоты требует более высокой температуры проведения процесса, в результате чего наблюдается образование о- и м- изомеров и выход целевого продукта снижается. Выделение нитросоединения осуществляют сливанием реакционной массы в охлажденную воду. Ранее использовался другой метод получения хлорамфеникола, в котором проводилось нитрование не метилового эфира, а самого хлоргидрина стирола:
При взаимодействии хлоргидрина стирола с азотной кислотой образуется нитроэфир 4-нитрофенилхлорметилкарбинола. Полученную реакционную массу выливают в воду до содержания азотной кислоты 28 – 30 %, добавляют мочевину для предупреждения окисления азотной кислотой и оксидами азота и кипятят 5 ч для гидролиза нитроэфира. В результате гидролиза образуется 4-нитрофенилхлорметилкарбинол, выделение которого осуществляют сливом реакционной массы в воду. Этот метод имеет значительно меньшее число стадий, однако от него пришлось отказаться из-за высокой пожаро- и взрывоопасности нитроэфира. Кроме того, на стадии получения нитроэфира необходимо поддерживать низкую температуру (от минус 8 до минус 12 оС), несоблюдение этого жесткого температурного режима приводило к взрыву. Однако получение нитроэфиров используется в ряде химических производств, в т. ч. и для синтеза лекарственных соединений.
2.1.1.7. Получение нитроэфиров и N- нитросоединений
Так же как и при нитровании ароматических соединений, при получении нитроэфиров используют смесь азотной и серной кислот:
Наиболее известный процесс – получение нитроглицерина, промышленное производство которого осуществлено А.Б. Нобелем. Динамит содержит до 15 % нитроглицерина. По мнению А.Б. Нобеля, использование столь мощных взрывчатых веществ должно было привести к отказу от ведения войны. Увы, он ошибся. Но осталась высшая научная премия – Нобелевская, в основе которой лежит работа предприятий, переданных А.Б. Нобелем в фонд премии его имени.
Нитроглицерин в малых дозах используется в медицине для купирования приступов стенокардии. Менее резкое и более длительное действие, по сравнению с нитроглицерином, оказывает пентаэритрита тетранитрат (синоним – эринит). В тонком органическом синтезе используют N- нитроаминосоединения. При действии на них щелочей нитрогруппа отщепляется. Таким образом, нитрогруппа в синтезе может служить в качестве защитной группировки.
Получение N- нитросоединений является многотоннажным процессом. В качестве примера можно привести штатные взрывчатые вещества октоген и гексоген, являюшихся мощными бризантными взрывчатыми веществами.
|
||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 1291; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.013 с.) |