
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лабораторные методы получения алкеновСодержание книги
Поиск на нашем сайте Алкены (этилены) 1.1 Строение алкенов
Атомы углерода при двойной связи находятся в состоянии sp2-гибридизации. Двойная связь короче одинарной и составляет 0,134 нм. Вращение вокруг двойной связи невозможно, поэтому существуют цис- и транс- изомеры. Переход цис в транс и обратно возможен только при условии разрыва кратной связи (конфигурационные изомеры). 1.2 Получение алкенов В природе алкены в небольших количествах встречаются в нефти, природных газах и каменноугольных смолах. Алкены играют значительную роль в живой природе. Например, они являются составной частью ферамонов, непредельных жирных кислот. Важнейшая реакция получения алкенов в промышленности - это крекинг и дегидрирование. Крекинг:
Большое промышленное значение имеет дегидратация спиртов, которая протекает по правилу Зайцева:
Лабораторные методы получения алкенов 1.3.1 Дегидрогалогенирование галогенпроизводных Отщепление от наиболее замещенного атома водорода.
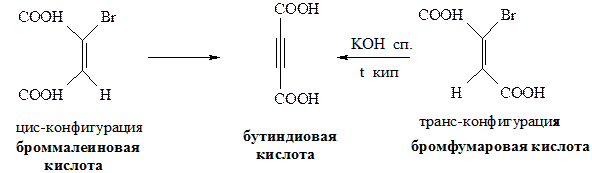
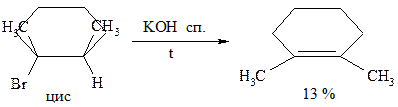
Правило Зайцева: отщепление Н-галоген от алкилгалогенидов протекает таким образом, что водород уходит от наименее гидрированного атома углерода. Исследованиями установлено, что реакции дегидрогалогенирования протекают стереоселективно, т.е. с образованием преимущественно одного из двух возможных продуктов. Возможно протекание реакции по мономолекулярному и бимолекулярному механизмам отщепления. Мономолекулярные реакции наблюдается в тех случаях, когда кинетика (скорость) процесса зависит от концентрации одного из взаимодействующих веществ, а бимолекулярные реакции - когда кинетика процесса зависит от концентрации двух взаимодействующих веществ: v1=K1 [R-Hal] - мономолекулярные v2=K2 [R-Hal] [ROK] - бимолекулярные Механизм Е2 реакции элиминирования (Е2 - бимолекулярный механизм). Реакция протекает лишь при транс- расположении отщепляющихся атомов (регеоселективность)
При невозможности транс расположения H и Hal реакция может вообще не протекать, или протекать, но с очень низким выходом. Рассмотрим на фиксированных структурах:
Механизм реакции E1 (мономолекулярной) Реакция протекает в две стадии: 1) Лимитирующая стадия
диссоциация по ионному механизму. 2) Быстрая, выброс протона от соседнего атома углерода
Для чего нужно транс-расположение H и Hal? Для того, чтобы основание RO¯ не испытывало пространственных взаимодействий с богатым электронами атомом галогена. Транс-расположение более важно при прохождении реакции по механизму E2. Некоторые закономерности реакции отщепления Механизм Е2 протекает исключительно как транс-элиминирование и не сопровождается перегруппировками (т.е. на промежуточной стадии не образуется карбокатион). Реакции Е1 сопровождаются нуклеофильным замещением и перегруппировкой. На самом деле вещества не реагируют исключительно по механизму Е1 или Е2. Так, если галогенпроизводное является третичным, наиболее вероятен механизм Е1. Если галогенпроизводное первичное, то наиболее предпочтителен механизм Е2. В случае вторичных галогенпроизводных возможно протекание реакции по обоим механизмам. Скорость реакции зависит также от основности алкоголят-аниона.
Если радикал R – третичный
В нуклеофильных перегруппировках (реакции Е1) может участвовать как углеводородный заместитель с парой электронов, так и гидрид-анион:
Расщепление четвертичных аммонийных солей по Гофману Протекает против правила Зайцева.
Химические свойства алкенов Присоединение галогенов
Реакция протекает количественно (с выходом около 100 % от теории). Наиболее энергично с алкенами взаимодействует фтор, наименее - йод. Реакции со фтором протекают с разрушением углерод-углеродных связей (фтор онолиз). Каталитическое присоединение воды Часто используется в промышленности для получения спиртов. Механизм:
Теперь возможно присоединение даже слабых нуклеофилов (вода) к положительно заряженному атому углерода
Присоединение спиртов По аналогичному механизму к алкенам присоединяются спирты:
Присоединение формальдегида Реакция катализируется 12%-ой серной кислотой. Реакция Принса. Катализ:
Реакции окисления алкенов 11) Гидроксилирование KMnO4 (реакция Вагнера), протекает как цис -процесс. Образуются цис -гликоли:
12) Эпоксидирование надкислотами по Прилежаеву:
При раскрытии эпоксида в щелочных средах образуются транс -диолы:
13) Эпоксидирование кислородом воздуха на серебре Служит для получения окиси этилена
14) Озанолиз Реакция озонирования алкенов до карбонильных соединений протекает по двойной связи:
1.4.11 Галогенирование в α-положение Реакция алкенов протекающая по свободно радикальному механизму могут проходить у углеродного атома находящегося рядом с двойной связью (аллильное положение). Хлорирование проводят при температуре около 500 °С (реакция Львова):
Бромирование в α-положение осуществляют N-бромамидом янтарной кислоты (N-бромсукцинимидом):
Реакции циклоприсоединения Алкены способны вступать в реакции, в которых образуется цикл (электроциклические, синхронные реакции). В зависимости от числа атомов вступающих в образование цикла они могут быть [2+1], [2+2], [2+4] и т.д. Например, реакция [2+4]:
R - любой алкил; R’ - акцептор (карбонил, карбоксил, нитрил, трихлорметил и т.д.). 2 Диены Различают три основных типа: Диены с разделенными двойными связями
подобные диены по свойствам напоминают алкены При n=1 диены стремятся образовать сопряженную систему, что приводит к смещению кратных связей. Сопряженные диены
Кумулированные диены
Простеший представитель
(tкип= -32 °C) Получают аллен:
Аллены термодинамически менее стабильны, чем ацетилены, поэтому их получить сложнее. Многие аллены проявляют биологическую активность Виды сопряженных диенов а) бутадиен-1,3 (дивинил)
б) изопрен
в) 2,3-диметилбутадиен
г) хлоропрен
Химические свойства диенов Реакции присоединения Большинство реакций подчиняется механизму электрофильного присоединения; особенность реакций диенов - 1,4-присоединение: Галогенирование
Гидрирование
Присоединение галоген-водородов Особенно избирательно реакция протекает с HBr:
При низких температурах (н.у.) преимущественно образуется продукт 1,2 – присоединения, при высоких - 1,4 присоединения. Механизм реакции [AE] для сопряженных диенов
Обозначим скорость перехода карбокатиона I в II через v1, тогда в зависимости от скорости взаимодействия карбокатиона I с анионом Br возможно преимущественное образование продукта 1,2- или 1,4-присоединения.
Реакции диенов с HBr более управляемы, чем с HCl, направление присоединения, (1,2- или 1,4-) зависит от температуры проведения процесса. Например, при гидробромировании дивинила более ощутим кинетический эффект, т.к. при -40°С количество продуктов 1,2-присоединения составляет около 80%, при +40°С - около 30%. Реакция 1,2-присоединения при низких температурах протекает быстрее, чем 1,4-присоединение, но термодинамически более выгодно 1,4-присоединение. Это подтверждается экспериментом: если реакционную массу, полученную при Таким образом, данная реакция при низких температурах подчиняется кинетическому контролю, а при повышенных - термодинамическому контролю. Присоединение по радикальному механизму [AR]. Этот вид присоединения менее подвержен контролю, чем электрофильный. Радикальное присоединение может использоваться при получении полимеров или теломеров. Реакция, как и всякий радикальный процесс, протекает в направлении образования более устойчивых (стабильных) радикалов. Однако в случае присоединения к сопряженным диенам образуются аллильные радикалы, отличающиеся большой стабильностью.
Далее реакция идет с наиболее устойчивыми радикалами:
Радикальные процессы менее избирательны, чем ионные, поэтому в результате данной реакции образуются все 4 продукта 1,2- и 1,4-присоединения (приведены только два). Реакция Дильса-Альдера (диенового синтеза) В процессе получения дивинила А.В. Лебедев отмечал, что в продуктах присутствовали циклическое соединение:
Дильс и Альдер досконально изучили этот процесс (циклоприсоединение).
Реакции проводят в запаянной ампуле при нагревании. Диенофил - соединение с двойной связью с акцепторной группой X. Некоторые аспекты применения сопряженных диенов Натуральный каучук Полимер изопрена стереорегулярного строения с цис -конфигурацией макромолекулы. Млечный сок бразильской гевеи.
Получить в промышленности стереорегулярность, как у натурального каучука долгое время не удавалось. Полимеризация дивинила приводит к следующим аддуктам:
Циглер и Натт получили катализаторы стереорегулярной полимеризации – смесь TiCl4 и Al (C2H5)3. Сейчас в промышленности получают стереорегулярные каучуки с целевыми свойствами (высокоэластичные, бензостойкие, маслостойкие, с низкими температурами стеклования и т.д.). Кроме указанных выше катализаторов, в исходные мономеры добавляют небольшие количества определенных веществ-сополимеров, которые встраиваются в макромолекулы полимеров. В этом случае процесс называют сополимеризацией:
Каучук - это еще не резина, вулканизация каучука заключается в образовании серных мостиков между макромолекулами:
В настоящее время синтетические каучуки по отдельным характеристикам превосходят натуральные. Алкины (ацетилены) Способы получения ацетилена · Карбидный способ Карбид кальция получают на основе известняка: сжигают природный известняк при высокой температуре
полученную окись кальция сплавляют с углем
при взаимодействии с водой карбид кальция образует ацетилен
Подобный способ не дает чистый ацетилен, в нем присутствуют производные серы, азота, фосфора. Для очистки применяют раствор хлорной извести. Гетероатомы переходят в высшую степень окисления:
· Крекинг углеводородов Пропускают газообразные углеводороды через специальные печи с температурой 1200¸1400 °С. Кроме ацетилена образуются сопутствующие газы - метан и водород. Термоокислительный крекинг метана Часть метана тратится на поддержание температуры процесса (около 1400 °С):
Электрокрекинг водорода Получение ацетилена в электрической дуге с параметрами 7000 В, 1000 А. Газообразные углеводороды пропускают через стальную трубу со скоростью 10 м/с. Химические свойства Реакции присоединения · Присоединение водорода Водород на катализаторах гидрирования восстанавливает алкины до алканов.
Чтобы остановить реакцию на стадии образования алкенов используют специальные добавки к катализаторам благородной группы:
Из химических восстановителей используют гидриды.
В отличии от гидрирования каталитического, которое приводит к образованию цис -алкенов, химические восстановители дают транс -алкены. В настоящее время в промышленности применяют жидкие гидриды алюминия: (RO)2AlH - жидкость светло-желтого цвета, R = C4H9. · Присоединение галогеноводородов Метод широко используется в промышленности для получения хлорвинила, дихлорэтана, тетрахлорэтилена и других хлорпроизводных. Реакция протекает по электрофильному механизму:
· Присоединение галогенов Реакция применяется для синтеза тетрахлорэтилена. В промышленности получают всевозможные продукты с применением влажной окиси или гидроокиси Ca - агенты мягкого отщепления H-X (дегидрогалогенирующие реагенты).
Для получения тетрахлорэтилена применяют двухстадийный метод:
Присоединение хлора к ацетиленам протекает очень бурно, безопасное хлорирование можно проводить в растворе переносчика хлора: [SbCl5·Cl2HC-CCl3] - комплекс пятихлористой сурьмы с пентахлорэтаном. Реакции нуклеофильного присоединения к ацетиленам · Присоединение воды Вода относится к нейтральным нуклеофилам.
Механизм реакции: Активирование ацетилена комплексом со ртутью
· Присоединение спиртов Спирты несколько более сильные нейтральные нуклеофилы, чем вода:
Реакция присоединения спиртов к ацителенам называется винилированием спиртов:
Виниловые эфиры - устойчивая форма существования виниловых спиртов (енолов). Алкены (этилены) 1.1 Строение алкенов
Атомы углерода при двойной связи находятся в состоянии sp2-гибридизации. Двойная связь короче одинарной и составляет 0,134 нм. Вращение вокруг двойной связи невозможно, поэтому существуют цис- и транс- изомеры. Переход цис в транс и обратно возможен только при условии разрыва кратной связи (конфигурационные изомеры). 1.2 Получение алкенов В природе алкены в небольших количествах встречаются в нефти, природных газах и каменноугольных смолах. Алкены играют значительную роль в живой природе. Например, они являются составной частью ферамонов, непредельных жирных кислот. Важнейшая реакция получения алкенов в промышленности - это крекинг и дегидрирование. Крекинг:
Большое промышленное значение имеет дегидратация спиртов, которая протекает по правилу Зайцева:
Лабораторные методы получения алкенов 1.3.1 Дегидрогалогенирование галогенпроизводных Отщепление от наиболее замещенного атома водорода.
Правило Зайцева: отщепление Н-галоген от алкилгалогенидов протекает таким образом, что водород уходит от наименее гидрированного атома углерода. Исследованиями установлено, что реакции дегидрогалогенирования протекают стереоселективно, т.е. с образованием преимущественно одного из двух возможных продуктов. Возможно протекание реакции по мономолекулярному и бимолекулярному механизмам отщепления. Мономолекулярные реакции наблюдается в тех случаях, когда кинетика (скорость) процесса зависит от концентрации одного из взаимодействующих веществ, а бимолекулярные реакции - когда кинетика процесса зависит от концентрации двух взаимодействующих веществ: v1=K1 [R-Hal] - мономолекулярные v2=K2 [R-Hal] [ROK] - бимолекулярные Механизм Е2 реакции элиминирования (Е2 - бимолекулярный механизм). Реакция протекает лишь при транс- расположении отщепляющихся атомов (регеоселективность)
При невозможности транс расположения H и Hal реакция может вообще не протекать, или протекать, но с очень низким выходом. Рассмотрим на фиксированных структурах:
Механизм реакции E1 (мономолекулярной) Реакция протекает в две стадии: 1) Лимитирующая стадия
диссоциация по ионному механизму. 2) Быстрая, выброс протона от соседнего атома углерода
Для чего нужно транс-расположение H и Hal? Для того, чтобы основание RO¯ не испытывало пространственных взаимодействий с богатым электронами атомом галогена. Транс-расположение более важно при прохождении реакции по механизму E2. Некоторые закономерности реакции отщепления Механизм Е2 протекает исключительно как транс-элиминирование и не сопровождается перегруппировками (т.е. на промежуточной стадии не образуется карбокатион). Реакции Е1 сопровождаются нуклеофильным замещением и перегруппировкой. На самом деле вещества не реагируют исключительно по механизму Е1 или Е2. Так, если галогенпроизводное является третичным, наиболее вероятен механизм Е1. Если галогенпроизводное первичное, то наиболее предпочтителен механизм Е2. В случае вторичных галогенпроизводных возможно протекание реакции по обоим механизмам. Скорость реакции зависит также от основности алкоголят-аниона.
Если радикал R – третичный
В нуклеофильных перегруппировках (реакции Е1) может участвовать как углеводородный заместитель с парой электронов, так и гидрид-анион:
|
||
|
Последнее изменение этой страницы: 2016-06-24; просмотров: 1482; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.007 с.) |

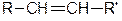 , R и R’ - алкильные заместители.
, R и R’ - алкильные заместители.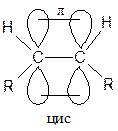

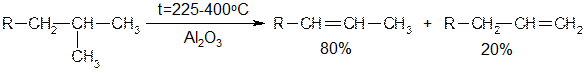
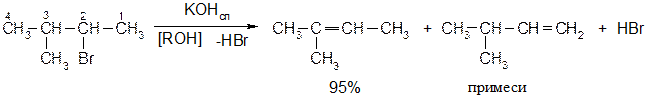

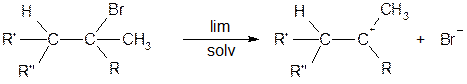


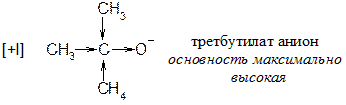

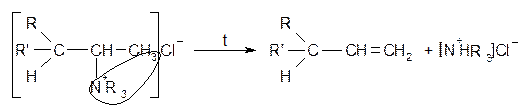
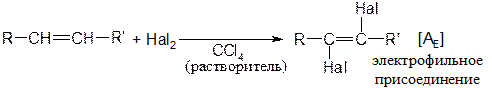
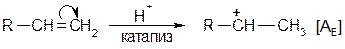
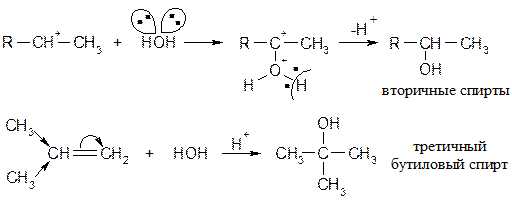
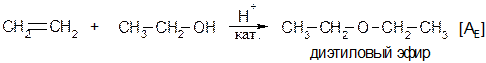 .
.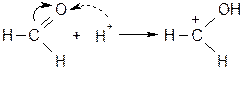
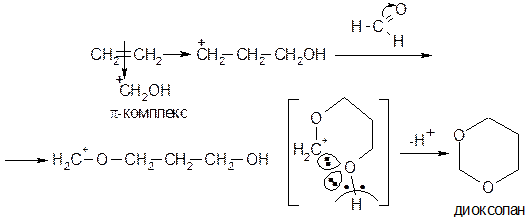

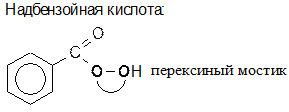
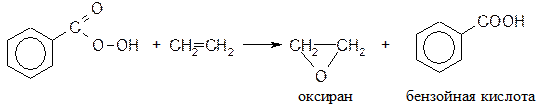
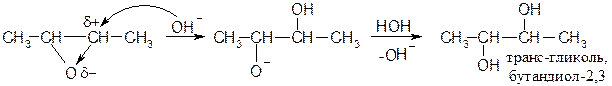
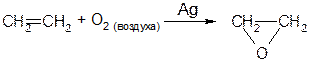
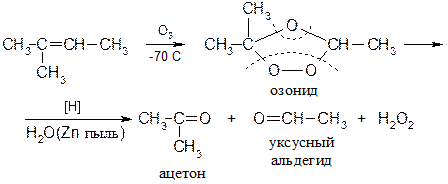
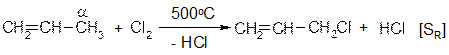
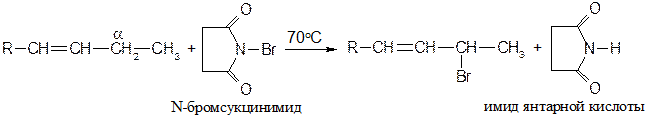
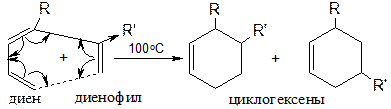
 n³1
n³1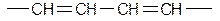
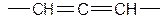
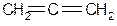 аллен
аллен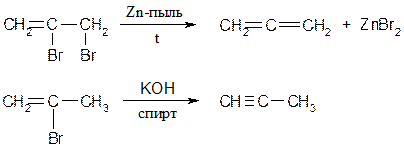 .
.

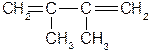

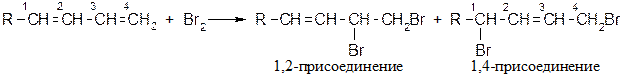
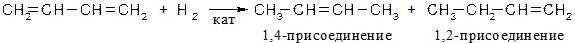
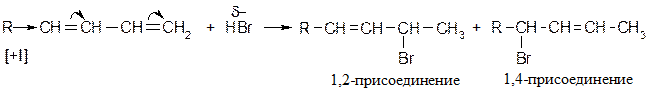

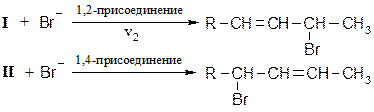
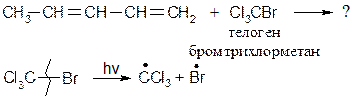

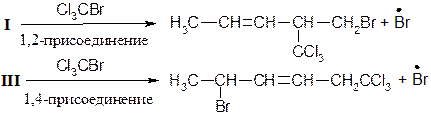

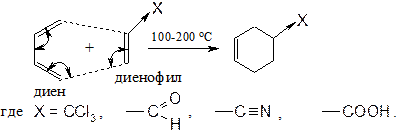
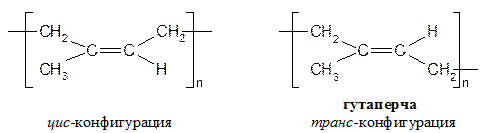
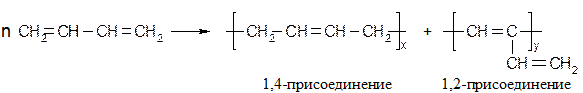
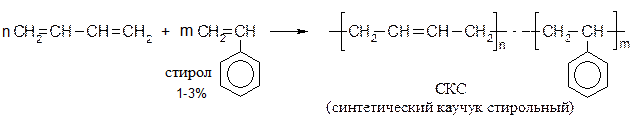

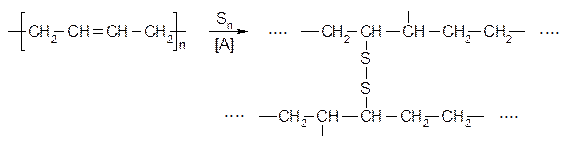
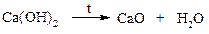 ;
;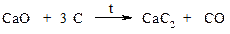 ;
;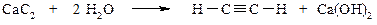 .
.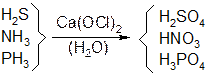 .
.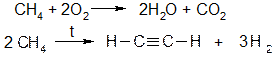
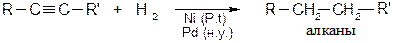
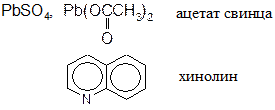
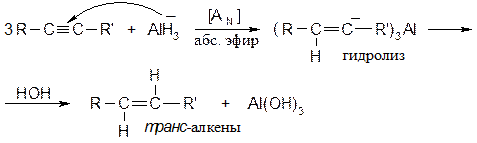
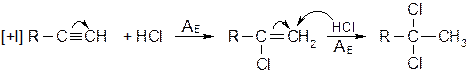
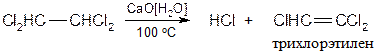
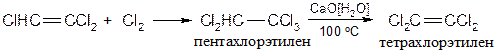
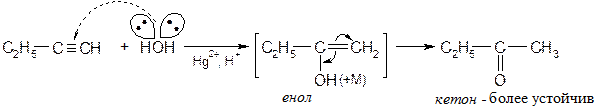
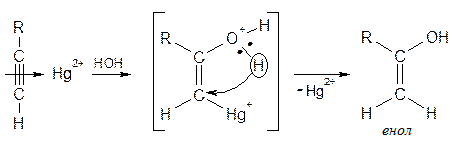
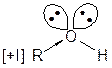 .
.



