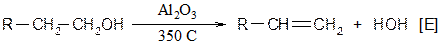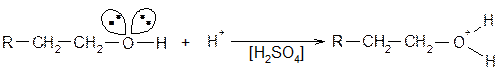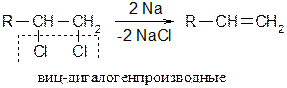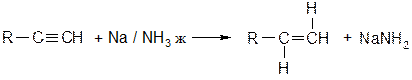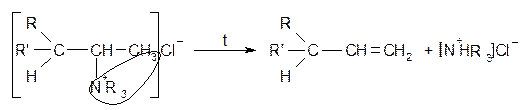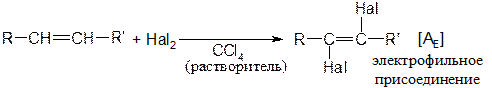Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дегидратация спиртов (отщепление воды)Содержание книги
Поиск на нашем сайте
Подчиняется тем же закономерностям, что и другие реакции элиминирования. Катализаторы отщепления Окислы алюминия и силикаты:
При химической дегидратации катализаторами являются H2SO4, H3PO4 и их соли. Схема реакции та же, но механизм элиминирования особый, только для спиртов. Механизм: 3) Протонизация спиртов
4) Отщепление воды
[первая стадия механизма Е1] 5) Выброс протона от α-углеродного атома
[вторая стадия – как в механизме Е1] Таким образом, реакция может сопровождаться перегруппировками углерод-углеродного скелета. Реакция легче протекает с третичными спиртами (стабильные карбокатионы). Менее гидрогенизированный атом углерода на последней стадии легче отдает протон. Одна из разновидностей химической дегидратации - это дегидратация в присутствии кислот Льюиса. Механизм:
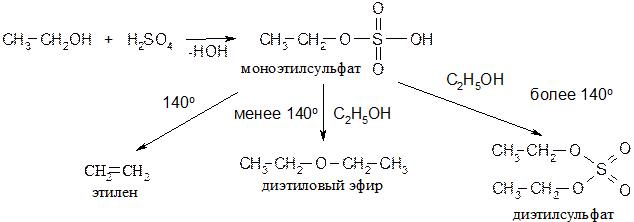
В условиях реакции с серной кислотой в промышленности процесс проводят в две стадии через получение сернокислых эфиров. Это дает возможность получать не только алкены, но и дисульфоэфиры и простые эфиры. Пример:
Дегалогенирование дигалогенпроизводных Вицинальные дигалогенпроизводные в условиях реакции Вюрца образуют алкены
Более стабильные результаты получают при использовании вместо Na цинковой пыли. 1.3.4 Восстановление алкинов (ацетиленов) Алкины можно восстанавливать до цис- или транс-алкенов. Для получения цис-конфигурации двойной связи восстановление проводят водородом на катализаторе Линдлара или частично отравленных благородных катализаторах. 4% Pd(CaCO3) Pb(OCOCH3) (ацетат свинца или нитрат свинца) Подтравливать можно хинолином. При использовании Pd на CaCO3 алкины восстанавливаются до алкенов. Транс-алкены можно получить при восстановлении натрием в жидком аммиаке.
Сильным химическим восстановителем является алюмогидрид лития или его алкоголяты: LiAlH4 - алюмогидрид лития, твердый, порошкообразный, пирофорный. AlH(OR)2 - алкоголят, жидкий, светло-зеленого цвета, не загорается, не пирофорный. Расщепление четвертичных аммонийных солей по Гофману Протекает против правила Зайцева.
Термическое расщепление сложных эфиров по Коупу При нагревании ацетатов выше температуры кипения (плавления) они разлагаются, образуя продукты элиминирования по правилу Зайцева:
1.3.7 Реакция Фиттига На первой стадии получают комплекс алкилгалогенида с трифенилфосфином.
Далее комплекс вводят в реакцию с карбонильным соединением:
Образующееся соединение фосфора называют трифенилфосфиноксид (окись трифенилфосфина). Реакцию проводят в растворе супероснования (смесь гидроксид калия - диметил сульфоксид):
Реакция Фиттига дает цис -алкены. Химические свойства алкенов Гидрирование (восстановление) Проводят на катализаторах благородной группы (палладий, платина) или на металлах переходной группы (Fe, Co, Ni). Чаще всего Ni. NiRe - сплав Ni с Al,с последующим выщелачиванием Al щелочью (NaOH):
Катализаторы на основе Ni требуют повышенных температур и давлений (до 200 ºС и до 250·105 Па). Существуют катализаторы гомогенного гидрирования (жидкости, легко растворимы в органических растворителях). Трифенилфосфинпалладий хлорид [P(Ph)3]PdCl Трифенилфосфинрутений гидрохлорид [P(Ph)3]Ru·HCl Пространственные эффекты гидрирования На основании наблюдений за процессом гидрирования алкенов на гетерогенных катализаторах (Ni, Pd) был предложен следующий механизм:
Разрыхление связей между атомами водорода приводит к более активной форме восстановителя (атомарный водород). Процесс протекает как цис- гидрирование. За открытие катализаторов гомогенного гидрирования а Джеффри и Уилкинс стали Нобелевскими лауреатами 1973 года. Данные катализаторы работают региоспецифично.
Соединения бора с водородом – бораны также являются сильными восстановителями. Например:
Присоединение галогенов
Реакция протекает количественно (с выходом около 100 % от теории). Наиболее энергично с алкенами взаимодействует фтор, наименее - йод. Реакции со фтором протекают с разрушением углерод-углеродных связей (фтор онолиз).
|
||||
|
Последнее изменение этой страницы: 2016-06-24; просмотров: 1278; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.14.245.172 (0.005 с.) |