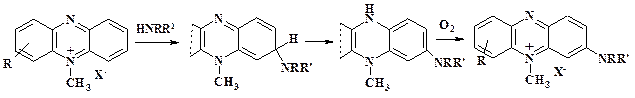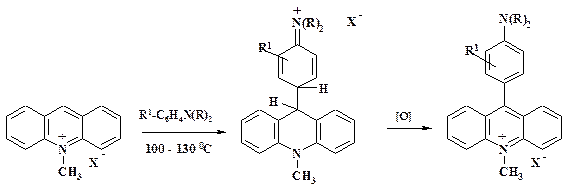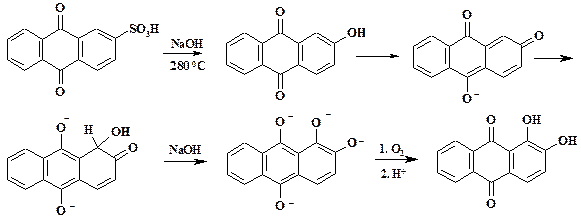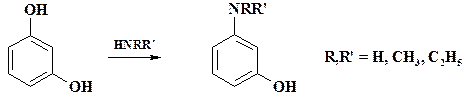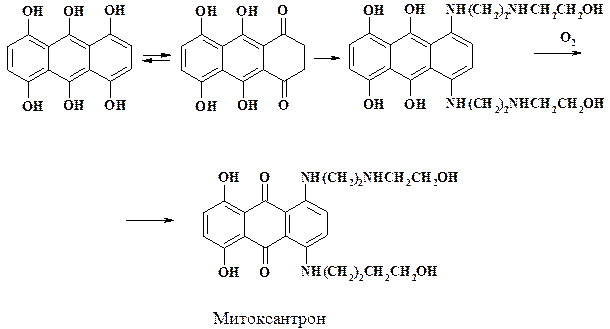Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Нуклеофильное замещение водородаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Недостатком рассмотренных реакций ипсо- замещения групп (SNipsoAr, SNAr) является то, что для введения в цикл нужной группировки необходимо провести одну или несколько реакций с электрофильными агентами. Только затем один из заместителей обменять на нуклеофил. Весьма привлекательно, подобно реакциям электрофильного замещения, напрямую ввести нуклеофил с отщеплением атома водорода. Но при взаимодействии с электрофильной частицей водород отщепляется в виде протона. В случае реакции с нуклеофилом водород формально должен уходить в виде гидрид аниона. Следовательно, для прямого нуклеофильного замещения водорода необходимо дополнительно использовать акцептор электронов, тогда будет отщепляться протон и два электрона, а акцептор будет восстанавливаться. По классификации эти реакции следует обозначить как SNHAr или сокращенно SNH, т. к. превращение может происходить только в ароматических соединениях. В настоящее время накоплен большой материал, показывающий, что реакции SNH не являются чем-то экзотическим или неожиданным. Классическим примером такого превращения является реакция Чичибабина:
Пиридин при взаимодействии с амидом натрия в ксилоле или диметиланилине дает 2-аминопиридин. Реакцию можно проводить в других инертных растворителях. В жидком аммиаке процесс идет в гомогенной фазе при температуре минус 33 оС. Использование амида натрия позволяет удалить водород из s-аддукта в виде Н2. При занятых в пиридине a-положениях образуется производное 4-аминопиридина. Помимо пиридина в реакцию вступают хинолин и его производные, изохинолин, 1-замещенные бензимидазола и производные бензотиазола. Азины в жидком аммиаке образуют s-аддукты, окисление которых перманганатом калия приводит к образованию аминопроизводных. Например 2-метилтио-5-нитропиримидин при взаимодействии с аммиаком при - 40 оС дает 2-метилтио-5-нитро-6-аминопиримидин.
Несмотря на наличие в молекуле двух легко уходящих нуклеофугных групп – метилтио- и нитрогруппы, образуется при кинетическом контроле sН-аддукт (аддукт Сервиса), окисление которого приводит к аминопроизводному. Аналогично реагируют производные хинолина, триазина, птеридина и тетразина. Выход аминопроизводных в зависимости от типа активированного гетероцикла колеблется от 30 до 80 %. Активированные азины, в частности четвертичные соли, при взаимодействии с аммиаком, первичными и вторичными аминами при комнатной температуре образуют аминодигидропроизводные. Например, четвертичные соли феназина в реакции с аминами дают sН-аддукт, который превращается в стабильный дигидрофеназин. Окисление последнего кислородом воздуха приводит к четвертичной соли аминофеназина.
Аналогично идет реакция и с производными фенотиазина и феноксазина:
Подобно аминам реагируют и СН-кислоты. Четвертичные соли акридина, как было обнаружено О.Н. Чупахиным, реагируют даже с такими слабыми С-нуклеофилами, как производные анилина:
Промежуточный sН-аддукт был выделен, строение его доказано. Данная работа положила начало циклу систематических исследований реакций нуклеофильного замещения водорода в ряду гетероциклов. Как отмечалось в разделе 2.1.1, при получении нитробензола из бензола образуется примесь нитрофенолов. Наиболее вероятно, что это является результатом радикальной реакции. Идея прямого получения нитрофенолов из нитробензола с помощью реакции нуклеофильного замещения водорода весьма привлекательна. По патентным данным при взаимодействие нитробензола с мелкодисперсным КОН в диметоксиэтане в присутствии 18-краун-6-эфира и окислении s-аддукта кислородом воздуха с высоким выходом образуются нитрофенолы:
Краун-эфир хорошо комплексует ионы калия. Реакционная способность гидроксид аниона возрастает и реакция идет уже при 60 – 70 оС, выход нитрофенолов составляет 90 – 95 %. Однако нет данных о том, что этот оригинальный метод используется в промышленности. Синтез краун-эфиров и их свойства рассмотрены в разделе 2.7. Для п -замещенных производных нитробензола при взаимодействии их с порошком КОН и пропускании воздуха показана возможность получения соответствующих нитрофенолов:
Когда X = F, NO2, идет ипсо- замещение этих групп с образованием 4-нитрофенола. Это хорошо иллюстрирует тот факт, что увеличение скорости образование s-аддукта Джексона-Мейзенгеймера (см. раздел 2.2.3.3) приводит к протеканию реакции SNipsoAr, а не SNH. Проведение реакции в жидком аммиаке с использованием в качестве окислителя гидроперекиси кумола дает производные 4-нитрофенола, независимо от характера заместителя Х. Выход нитрофенолов составляет 70 – 90 %.
По всей вероятности, в предыдущем примере реакции SNH лимитирующей стадией процесса является окисление sН-аддукта. Введение в реакционную массу окислителя приводит к преимущественному превращению по механизму SNH. Метод также пока не нашел применения в промышленности. Аналогично замещению водорода на аминогруппу в гетероциклах, хиноны стабилизируют sН-аддукт после атаки аниона. Так в реакции Тиле-Винтера в кислой среде образуется триацетилгидроксибензол:
Первой стадией процесса является протонирование бензохинона, положительный заряд делокализован между атомом кислорода и углерода цикла. Ацетат анион атакует реакционный центр с образованием s-аддукта. Перенос протона из аддукта на атом кислорода хинона приводит к ароматизации цикла. При избытке уксусного ангидрида происходит ацилирование фенольных групп. Триацетильное производное с помощью кислого гидролиза превращают в 1,2,4-тригидроксибензол. В промышленном синтезе стойкого кубового красителя ализарина (1,2-дигидроксиантрахинона) также наблюдается прямое гидроксилирование. При щелочном плавлении антрахинон-2-сульфокислоты при 280 оС вначале получается 2-гидроксиантрахинон. Наличие хиноидной структуры облегчает атаку гидроксид аниона. Образуется тетранатриевая соль тетрагидроксиантрацена, окисление которой с последующим подкислением дает ализарин.
Получение некоторых красителей антрахинонового ряда включает реакцию замещения водорода гидроксид анионом. Разработана новая безотходная технология получения п- нитроанилина:
При взаимодействии бензамида, нитробензола, аммиака и кислорода в одну стадию получают п- нитроанилин.
Викариозное нуклеофильное замещение. Во многих случаях прямое введение нуклеофила идет по так называемому типу реакций викариозного замещения водорода (викарий – помощник пастора). Нуклеофил содержит группировку, которая отщепляется и уносит с собой протон из sН-аддукта
При замещении водорода в производных 2,4-динитробензола с двумя молекулами гидроксиламина в этилате натрия образуется аддукт, при разложении которого отщепляются две молекулы воды. При этом получают производные 3,5-диамино-2,4-динитробензола. Ароматизация sН-аддукта происходит за счет переноса протона к атому азота при одновременном отщеплении гидроксид аниона (ОН – викариозная группа). Хорошим аминирующим агентом является N -аминотриазол:
При взаимодействии 3-замещенных производных нитробензола с этим соединением в ДМСО в присутствии третбутилата калия при 20 – 30 оС получены производные нитроанилина. Анионный s-аддукт ароматизируется за счет отщепления триазолат аниона и передачи протона к атому азота. Выход целевых продуктов составляет 70 – 90 %. Еще в начале ХХ в. было найдено, что реакция хинолина (изохинолина, фенантридина) с хлорангидридами кислот и цианидом натрия дает устойчивые соединения Райсерта (реакция Райсерта):
При кислотном гидролизе протон s-аддукта смещается к атому кислорода карбонильной группы, образуется хинолинкарбоновая кислота и альдегид. Это превращение позволяет получать широкий круг альдегидов. N-Оксиды азинов легко вступают в реакции нуклеофильного замещения водорода. Так при взаимодействии хинолин-N-оксида с тозилхлоридом и спиртами в присутствии триэтиламина образуются 2-алкоксихинолины:
Аналогично N-оксиды реагируют с N-, P- и С-нуклеофилами. Реакция с С-нуклеофилом используется в синтезе промежуточного продукта при получении диазепама. Препарат диазепам (седуксен, реланиум, сибазон, валиум) является транквилизатором. Полный синтез препарата приведен в разделе 2.7.
При взаимодействии п -нитрохлорбензола с цианистым бензилом в щелочной среде в условиях реакции нитрил фенилуксусной кислоты, как СН-кислота, образует анион, который атакует молекулу нитрохлорбензола с получением s-аддукта. Его стабилизация происходит за счет отщепления цианистого натрия, дегидратация приводит к производному бензоизоксазола. Выход бензоизоксазола составляет 70 %.
Кине-, телезамещение водорода. Как уже отмечалось, при взаимодействии нуклеофила с ареном быстро образуются s-аддукты Сервиса. Это объясняет аномальное течение реакций нуклеофильного замещения, когда нуклеофил встает в о- или м- положение к нуклеофугной группе (кине- и теле-замещение). Так при взаимодействии 2,3-динитронафталина с гидразин гидратом, в отличие от о- динитробензола, образуется 1-гидразино-3-нитронафталин:
При взаимодействии о- нитробензонитрила с цианид ионом также наблюдается нуклеофилное замещение:
В sН-аддукте происходит атака кислорода нитрогруппы с образованием оксазиридиноксида. Его расщепление дает 2,6-дицианофенол и оксид азота. В качестве примера теле -замещения можно привести реакцию амида калия в жидком аммиаке с 8-хлор-1,7-нафтиридином:
В отличие от классической реакции Чичибабина, в данном случае отщепляется хлороводород, а не водород.
Замещение гидроксигрупп
Фенолы, не содержащие электроноакцепторных группировок, вступают в реакцию аминирования при высоких температурах. Так фенол реагирует с аммиаком в паровой фазе при давлении 20 МПа и температуре 400 оС на стационарном алюмосиликатном катализаторе, давая анилин с выходом 98 %.
C6H5-OH → C6H5-NH2
Метод может конкурировать с традиционным способом получения анилина из нитробензола. Следует отметить, что в этом варианте практически нет отходов. Стабилизатор каучуков 2-фениламинонафталин получают из анилина и нафтола-2 при 240 – 250 оС в расплаве с добавкой хлорида анилиния или бензолсульфокислоты:
Процесс ведут в течение 6 ч при отгонке воды. Полученный продукт перегоняют в вакууме. При более низкой температуре идет замещение в полигидроксипроизводных. Пропускание аммиака в расплав резорцина при 160 оС приводит к м- аминофенолу. Реакцией с диметил- и диэтиламинами получают соответствующие производные м- аминофенола:
Важное промышленное значение имеет замещение гидроксигруппы на аминогруппу в присутствии солей сернистой кислоты (реакция Бухерера). Эта группа реакций не относится к нуклеофильному замещению в ароматическом ряду, т. к. механизм процесса другой. Он представлен на схеме:
Гидросульфит натрия присоединяется по двойной связи молекулы 1-окси-нафталина с получением 1-оксотетралин-3-сульфокислоты. Амины реагируют с кетогруппой по механизму присоединения-отщепления (см. раздел 2.2.2). После отщепления воды уходит также и сульфогруппа. При получении неозона Д по этому способу реакция идет в воде уже при 110 – 120 оС вместо 240 – 250 оС в отсутствии гидросульфита натрия. Данным методом синтезируют азосоставляющие: Гамма-кислоту, кислоту Тобиаса и Н-кислоту (аминонафталинсульфокислоты). Способ используется при получении препарата митоксантрон, который является синтетическим аналогом антрациклиновых антибиотиков. Митоксантрон используют для лечения рака молочной железы с локальными и отдаленными метастазами, острого лейкоза и миелолейкоза. Препарат нарушает структуру и функции ДНК, блокирует топоизомеразу II в раковых клетках.
Восстановленный тетрагидроксиантрахинон (лейкотетрагидроксиантрахинон) может находиться в двух таутомерных формах. С амином в бутаноле при 100 оС реагирует форма диона, образующееся аминопроизводное окисляют кислородом воздуха до целевого продукта. Следует отметить то, что препарат окрашивает животные ткани и может вызвать мутации. Поэтому при его синтезе необходима тщательная защита персонала от контакта с веществом.
|
||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 1174; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.012 с.) |