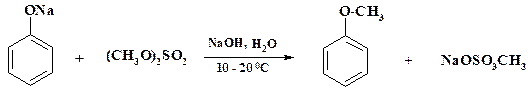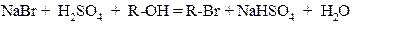Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Алкилирование спиртов и феноловСодержание книги
Поиск на нашем сайте В отличие от реакций аминов с алкилирующими агентами, взаимодействие их со спиртами и фенолами идет однозначно. В качестве примера может быть приведен синтез препарата димедрол:
Бензгидрол смешивают с измельченным гидроксидом натрия и прибавляют b-диметиламиноэтилхлорид, продукт экстрагируют бензолом и очищают разгонкой в вакууме. Для получения субстанции препарата обрабатывают сухим хлористым водородом жидкий b-диметиламиноэтиловый эфир бензгидрола в спирте или в хлорбензоле. Процесс выделения димедрола контролируют потенциометрически. Исходным продуктом является b-диметиламиноэтилхлорид, который получают из b-диметиламиноэтанола реакцией с хлористым тионилом. Синтезируют b-диметиламиноэтанол из этиленхлоргидрина с избытком диметиламина, либо при взаимодействии диметиламина с этиленоксидом. Морфолин (тетрагидро-1,4-оксазин), широко используемый в синтезе БАС, получают внутримолекулярным алкилированием гидроксигруппы в диэтаноламине. Реакция идет в присутствии серной кислоты при температуре 170 – 180 оС. После подщелачивания реакционную массу перегоняют.
Также широко используется в тонком органическом синтезе анизол. Его получают метилированием фенола диметилсульфатом:
Процесс идет в мягких условиях, однако в реакцию вступает только одна метильная группа диметилсульфата. Полное использование сырья возможно, если реакцию проводить при 110 – 120 оС. Алкилирование фенолята натрия в тех же условиях хлоруксусной кислотой дает феноксиуксусную кислоту, которая является промежуточным продуктом при получении феноксиметилпенициллина.
Первой стадией получения препарата папаверин (подробно синтез препарата рассмотрен в разделе 3.7) является метилирование пирокатехина.
Процесс ведут в емкостном аппарате из нержавеющей стали. Растворяют пирокатехин в диметилсульфате, добавляют воду и при интенсивном перемешивании медленно прибавляют из мерника 25 % раствор гидроксида натрия. По сравнению с расчетными данными диметилсульфат берут с двукратным избытком, т. к. в щелочи идет побочная реакция гидролиза метилсерного эфира. После окончания реакции вератрол отгоняют с острым паром. В этом процессе из двух метильных групп диметилсульфата вступает в реакцию только одна. При отгонке вератрола происходит гидролиз метилсульфата натрия с образованием сульфата натрия и метанола. Аналогично синтезируют о -диэтоксибензол, являющийся исходным продуктом при получении дротаверина (но-шпа). В качестве алкилирующего средства используют диэтилсульфат.
Алкилирование СН кислот
Алкилирование СН-кислот используется при получении барбитуратов. Практическое значение препараты этого ряда получили более ста лет тому назад после открытия Гутдейгом в конце XIX в. снотворного эффекта у барбитала (веронал, 5,5-диэтилбарбитуровая кислота). В настоящее время применяются несколько десятков производных 5,5-диалкил-(или арилалкил)-барбитуратов в качестве снотворных, успокаивающих, противосудорожных средств и препаратов для наркоза. Они усиливают тормозное действие ГАМК, взаимодействуют с определенным участком ГАМК-рецепторного комплекса. В разделе 2.2.1.1 приведены формулы некоторых лекарственных средств ряда барбитуратов, применяемых в качестве снотворных и успокаивающих препаратов. Многие из них выпускают и применяют в виде натриевых солей, которые хорошо растворимы в воде и дают возможность использовать их в виде инъекционных растворов. Практически все препараты данного ряда получают по однотипной схеме из диалкил- или алкиларилмалоновых эфиров. Диалкилмалонаты получают ступенчатым введением алкильных радикалов в малоновый эфир реакцией натриймалонового эфира с бромалкилами. Малоновый эфир является слабой СН-кислотой, при взаимодействии с этилатом натрия образуется натриевая соль. Нельзя использовать гидроксид натрия, т. к. в этой реакции выделяется вода и концентрация соли ничтожна. Для алкилирования используют алкилбромиды. Реакционная способность алкильных эфиров серной или бензолсульфокислоты недостаточна. Синтез может быть рассмотрен на примере барбитала и барбамила.
Технологический процесс начинается с приготовления этилата натрия. Эту реакцию проводят в отдельном помещении цеха, т. к. производство является высокопожаро- и взрывоопасным. В реактор из нержавеющей стали загружают натрий и абсолютный спирт, выделяющийся водород через воздушку, выведенную на крышу, сбрасывают в атмосферу через гравийный фильтр. Спиртовый раствор этилата натрия передавливают в следующий реактор, находящийся уже в помещении цеха. К нему приливают небольшими порциями при температуре 10 – 15 оС безводный малоновый эфир, размешивают 0,5 ч и нагревают до 35 ± 5 оС. К полученному раствору натриймалонового эфира при этой же температуре постепенно прибавляют соответствующий бромалкил. После двухчасовой выдержки отгоняют основную массу спирта и в кубовый остаток добавляют воду для растворения бромистого натрия. Смесь отстаивают в делительной воронке: нижний слой водного раствора бромида натрия направляют на регенерацию брома, а верхний слой представляет собой сырой алкилмалоновый эфир, который обычно направляют на вакуум-разгонку. Второе алкилирование ведут аналогично: вначале получают натриевую соль этилмалонового эфира, а затем добавляют алкилбромид. На этой стадии при получении барбитала алкилирование проводят бромистым этилом, а при получении барбамила – бромизопентилом. Алкилирование ведут в более жестких условиях – при температуре 90 – 100 оС. Аналогичным способом вводят второй радикал. Полученный диалкилмалоновый эфир конденсируют с карбамидом в присутствии алкоголята натрия в спиртовом растворе при кипении, при этом получают натриевую соль диалкилбарбитурата. Если препарат используется в виде соли, то технический продукт передают на стадию получения фармакопейного препарата. Когда препарат является производным свободной барбитуровой кислоты, натриевую соль нейтрализуют раствором соляной или уксусной кислоты и после этого также подвергают очистке с целью получения фармакопейного продукта. Серьезной проблемой промышленного синтеза барбитуратов является дефицит бромистоводородной кислоты, используемой для получения бромалкилов. В настоящее время значительная часть (60 – 70 %) бромистоводородной кислоты регенерируется из растворов бромистого натрия (отход стадии алкилирования малонового эфира), причем применяется одностадийная технология получения бромалкилов, совмещающая реакцию выделения бромистоводородной кислоты из бромистого натрия серной кислотой и реакцию замены гидроксильной группы в спирте на бром:
В синтезе фенобарбитала исходным сырьем служит цианистый бензил, который является многотоннажным продуктом. Для получения пиримидинового цикла необходимо в качетве промежуточного продукта иметь производное фенилмалоновой или фенилциануксусной кислоты. Поэтому цианистый бензил конденсируют с диэтилкарбонатом в присутствии этилата натрия (условия реакций конденсации и гетероциклизации рассмотрены в разделе 2.7). Образующуюся натриевую соль этилового эфира 2-фенилциануксусной кислоты алкилируют бромистым этилом с получением этилового эфира 2-фе-нил-2-этилциануксусной кислоты. Условия реакции с бромистым этилом те же, что и при получении барбитала.
Для получения конечного продукта проводят циклизацию с циангуанидином, нитрильную и иминогруппу гидролизуют в серной кислоте. Синтез других препаратов этого ряда рассмотрен в разделе 2.7.
|
||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 2122; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.41 (0.007 с.) |