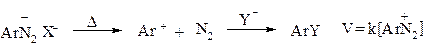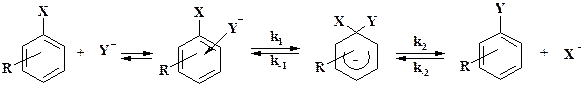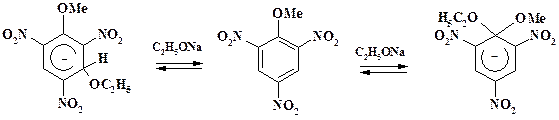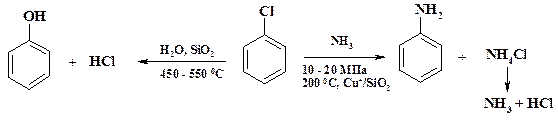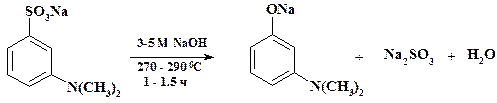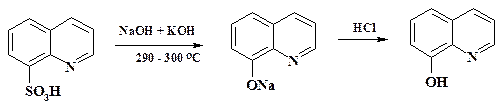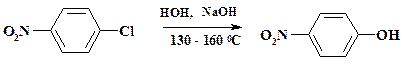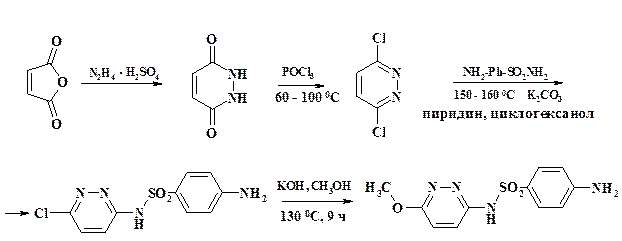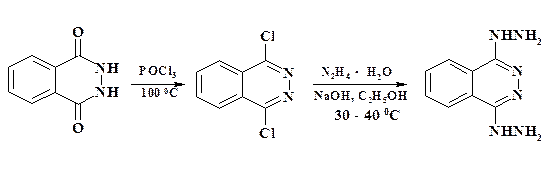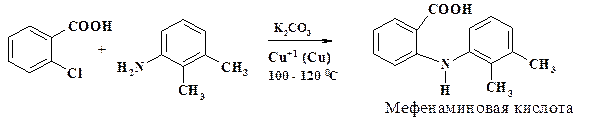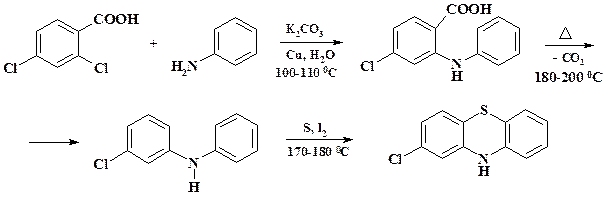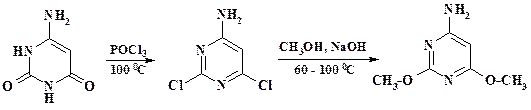Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ароматических и гетероциклических оединенийСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Значение реакций для органического синтеза и получения лекарственных средств. Виды реакций по механизму: типа SN1, ариновое замещение, присоединение–отщепление – SNAr, нуклеофильное замещение водорода (SNH), ANRORC. Кинетика, закономерности. Использование реакций нуклеофильного замещения в органическом синтезе и при получении хинозола, парацетамола, мефенаминовой кислоты, сульфаниламидных препаратов. Нуклеофильное замещение водорода в синтезе диазепиновых транквилизаторов. Реакция Бухерера, синтез препарата митоксантрон.
В промышленном органическом синтезе широко используются реакции нуклеофильного замещения при получении нитрофенолов и нитроанилинов (см. раздел 2.1.1), в медицинской промышленности – в синтезе препаратов хинозол, парацетамол, мефенаминовая кислота, сульфаниламиды и многих других. Биологическое действие ряда лекарственных средств уже было рассмотрено в предыдущих разделах, а для некоторых приведено в данном разделе при описании их синтеза. Реакции нуклеофильного замещения могут протекать по различным механизмам: 1) типа SN1; 2) аринный; 3) присоединение-отщепление (SNAr); 4) нуклеофильное замещение водорода (SNH); 5) ANRORC.
2.2.3.1. Нуклеофильное замещение по типу SN1
Тип SN1 реакций подробно рассмотрен в разделе 2.4. При нагревании ароматических солей диазония в кислой среде в отсутствие восстановителей наблюдается образование фенолов. Лимитирующей стадией реакции является образование карбокатиона:
Изучение кинетики процесса показало, что общий порядок реакции первый. Кроме того, константа скорости реакции не изменяется при переходе от воды к D2O. С помощью этого превращения диазониевой группы на заключительной стадии синтеза получают препарат фенилэфрин (мезатон).
Ариновое замещение Второй тип реакций является одним из видов замещения, но в качестве промежуточного продукта образуется дегидроарен (арин). Эта короткоживущая нейтральная частица возникает при действии сильных оснований на неактивированные галогенарилы. На первой стадии происходит отрыв протона в о- положении к галогену, а на второй отрыв атома галогена. В качестве сильного основания используют амид натрия в жидком аммиаке:
Легкость отрыва галогена уменьшается в следующем ряду: Br > Cl > F. В несимметричных ароматических производных реакция, как правило, приводит к получению смеси о- и м- изомеров. Их соотношение зависит в основном от характера заместителя: если он имеет отрицательный индуктивный эффект, то преимущественно образуется м -изомер. Так при реакции о -хлоранизола с амидом натрия в жидком аммиаке соотношение изомеров м-: о- составляет 95:5. В случае о -хлортолуола соотношение этих изомеров 45:55.
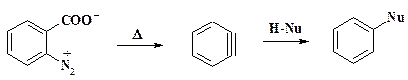
Ориентация нуклеофильного присоединения зависит также и от активности реагента. Чем выше его активность, тем меньше селективность. Помимо амида натрия в реакциях этого типа используют бутиллитий. Образование арина наблюдается и при разложении о- диазобензойной кислоты:
Проведение данной реакции в присутствии нуклеофила приводит к получению продукта присоединения этого нуклеофила.
2.2.3.3. Реакции нуклеофилов с ипсо- замещением Нуклеофугных групп В данном разделе рассмотрен третий тип реакций – классический механизм присоединения – отщепления SNAr. Описываемые процессы имеют большое значение как в ароматическом ряду, так и в ряду азинов. Нуклеофил и субстрат образуют p-комплекс, который превращается в s-аддукт.
Анионные s-аддукты, которые называют аддуктами Джексона – Мейзенгеймера, были выделены в твердом виде:
Они являются глубоко окрашенными веществами и подробно охарактеризованы с помощью ИК, УФ и ЯМР спектроскопии. По рентгеноструктурным данным все атомы углерода кольца и азота нитрогрупп лежат в одной плоскости, а метокси- и этоксигруппа – в плоскости, перпендикулярной кольцу. Подробное изучение взаимодействия тринитроанизола с этоксид анионом показало, что быстро образуется термодинамически менее стабильный 3-s-аддукт (аддукт Сервиса) и медленнее более устойчивый 1-s-аддукт.
Наличие на координате реакции аддукта Сервиса объясняет аномалии нуклеофильного замещения, а также синтетические возможности, вытекающие из этого, которые будут рассмотрены в случаях нуклеофильного замещения водорода. В реакциях, которые идут по обычному механизму SNAr, наиболее часто лимитирующей стадией является образование s-аддукта. При этом наблюдаются следующие кинетические закономерности:
Тот факт, что разрыв связи не определяет скорости реакции при замещении атома галогена, подтверждается значительно большей скоростью замещения фтора по сравнению с хлором и бромом. Энергия связи C-F больше, чем связей C-Cl и C-Br, но заряд на атоме углерода, связанным с атомом фтора, выше. Поэтому замещение фтора идет легче. Анализ литературных данных позволил Баннету и Цалеру установить по легкости отщепления нуклеофугных групп следующую последовательность:
F > NO2 > Cl ³ Br > I; Cl > N3 > SO3R > N+R3 > OАr > OАlk > SR > SO2R
Этот ряд хорошо согласуется с константами скорости реакции нитропроизводных бензола с пиперидином. В качестве стандартного образца взят п- нитрохлорбензол (k = 6,6×10 –5 л моль-1 с-1, k отн = 1). Данные представлены в табл. 2.12: Таблица 2.12
Изучение кинетики реакций показало, что r реакционных серий изменяется в пределах от + 3,1 до + 6,6. Для протекания реакции необходимо наличие электроноакцепторных заместителей. С учетом этих фактов можно продемонстрировать условия замещения нуклеофугных групп на аминогруппу:
Схема иллюстрирует условия замещения. Согласованное действие электроноакцепторных нитрогрупп в пикрилхлориде приводит к тому, что реакция идет при комнатной температуре. Уменьшение числа нитрогрупп требует повышения температуры проведения процесса. Сравнение условий замещения в о- динитробензоле и о- хлорнитробензоле показывает, что нитрогруппа уходит легче. Замещение атома хлора в о- хлорбензойной кислоте в приемлемых технологических условиях не идет без катализатора (см. в данном разделе синтез мефенаминовой кислоты). Для этих каталитических процессов (реакция Ульмана) используют мелкодисперсную медь или соли меди, нанесенные на силикагель или пемзу. Закономерности по реакционной способности уходящих групп другие. Так наблюдается следующая последовательность: I > Br > Cl > F. Поэтому в синтезе препарата трифтазин (получение 3-трифторметилдифениламина – раздел 2.3) в реакции нуклеофильного замещения в присутствии соли меди используют бромбензол с добавкой иодистого калия.
Получение полупродуктов и лекарственных препаратов. В отсутствие электроноакцепторных заместителей замещение атома хлора происходит при высокой температуре и в присутствии катализатора:
Одним из способов промышленного получения фенола и анилина является их синтез из хлорбензола. В настоящее время этот метод широко не используется. В приведенных на схеме процессах выделяется хлористый водород, который является высококоррозионно-активным продуктом, тем более при высокой температуре, а в случае получения фенола еще и в присутствии воды. Поэтому длительная эксплуатация аппаратуры в таких условиях обеспечивается применением сплава хастеллой, что удорожает производство. Лучшие результаты получены с использованием керамической аппаратуры. Однако в качестве растворителя хлорбензол широко применяется в органическом синтезе, и его утилизация представляет трудную экологическую проблему. В качестве способа решения данной проблемы получение из отработанного хлорбензола полезных продуктов становится рентабельным.
До внедрения кумольного метода производства фенола этот важный продукт получали щелочным плавлением бензолсульфокислоты. В настоящее время процесс щелочного плавления используют только в производстве малотоннажных веществ. Так в синтезе препарата неостигмин бромида промежуточный м -диметиламинофенол получают из соответствующей сульфокислоты:
К концентрированному водному раствору натриевой соли диметиламинобензолсульфокислоты (получение см. в разделе 2.1.3) постепенно добавляют NaOH и нагревают до 270 оС. Наблюдается бурное выделение воды, для сохранения подвижности расплава воду частично возвращают через обратный холодильник. После окончания реакции снижают температуру, плав «гасят» – разбавляют водой, реакционную массу передают в другой аппарат и подкисляют до рН 4 – 5, выделяющийся диоксид серы поглощают щелочью, осадок целевого продукта отфильтровывают. Однако при наличии в молекуле гидроксигруппы, реакция затруднена. Так при щелочном плавлении при температуре 330 – 350 оС 4-гидроксибензол-1,3-дисульфокислоты замещается только одна сульфогруппа и образуется 3,4-дигидроксибензолсульфокислота.
После гашения плава и десульфирования в 20 % серной кислоте образуется пирокатехин. Это соединение является исходным продуктом при получении препаратов папаверин и дротаверин. Альтернативным промышленным методом получения пирокатехина является щелочной гидролиз о -хлорфенола. Ранее 8-гидроксихинолин, который используют в синтезе препарата нитроксалин (о биологическом действии см. раздел 2.1.2), получали конденсацией о- аминофенола с глицерином (см. раздел 2.7) в серной кислоте.
Был разработан способ производства этого продукта, включающий сульфирование дешевого коксохимического хинолина с последующим щелочным плавлением сульфокислоты:
Метод синтеза из о -аминофенола является экологически более чистым. Однако при небольшом тоннаже производства, даже с учетом затрат на природоохранные мероприятия, альтернативная схема более рентабельна. Наряду с восстановлением нитро- и нитрозогрупп нуклеофильное аминирование в ряду ароматических и гетероциклических соединений является одним из наиболее распространенных способов получения аминопроизводных. Производство нитроанилинов является крупнотоннажным. Процессы, приведенные на схеме, ведут в автоклавах. Для успешного проведения реакции необходимо использовать пятикратный избыток аммиака. После окончания реакции аммиак стравливают и поглощают водой. Осадок целевого продукта отфильтровывают, к фильтрату добавляют щелочь, аммиак отгоняют и поглощают водой. Раствор аммиака вновь направляют в производство.
В значительно более мягких условиях проводят замещение хлора на аминогруппу в 2,4-динитрохлорбензоле: реакция идет уже при комнатной температуре. В качестве реагента для проявления хроматограмм при обнаружении аминокислот и пептидов используют 2,4-динитрофторбензол, т. к. реакция замещения фтора идет уже при комнатной температуре. Как отмечалось в разделе 2.1.1, прямое нитрование фенолов не используется из-за бурного течения реакции, значительного осмоления реакционной массы и больших затрат на разделение изомеров. Промышленным методом получения нитрофенолов является замещение галогена на гидроксигруппу. Так при синтезе парацетамола п -нитрофенол получают щелочным гидролизом п -нитрохлорбензола:
Реакцию ведут в автоклаве при интенсивном перемешивании. Применение межфазного катализа позволяет снизить время проведения процесса с 36 до 12 ч. Замещение хлора в 2,4-динитрохлорбензоле на гидроксигруппу идет уже при 100 оС. При получении фторхинолоновых препаратов один из атомов фтора замещают на пиперазин либо его метильное производное. Полный синтез препаратов приведен в разделе 2.3. Условия реакции приведены на схеме:
Как отмечалось в разделе 2.1.4, схема синтеза сульфапиридазина и сульфалена отличается от обычного метода получения сульфаниламидных препаратов. В этих случаях используют реакции нуклеофильного замещения в гетероциклическом ядре. В молекуле стрептоцида имеется две аминогруппы: одна в ароматическом цикле, вторая в сульфаниламидной группе. Основность первой группы выше, но в присутствии поташа на атоме азота сульфаниламидной группы возникает целочисленный отрицательный заряд, т. к. эта группировка имеет кислый характер. При солеобразовании возрастает нуклеофильность амидной группы и реакция идет региоселективно. Замещение второго атома хлора в пиридазиновом цикле не происходит в связи с тем, что в цикл уже введен электронодонорный заместитель. Замену оставшегося атома хлора на метоксигруппу проводят с метилатом натрия в автоклаве при температуре 130 оС.
В аналогичных условиях ведут синтез сульфалена:
В азинах атом азота (азагруппа) по своему электроноакцепторному эффекту приближается к нитрогруппе, поэтому реакции идут в отсутствие катализатора. В состав гипотензивного средства адельфан в качестве одного из компонентов входит 1,4-дигидразинофталазин – дигидралазин. Его получают с помощью замещения атома хлора на гидразиногруппу. Взаимодействие дихлорфталазина с таким сильным нуклеофилом, каким является гидразин гидрат, идет в мягких условиях с замещением обоих атомов хлора:
В отсутствие сильных электроноакцепторных заместителей приходится использовать реакцию Ульмана. Так в синтезе мефенаминовой кислоты проводят взаимодействие о -хлорбензойной кислоты с 3-ксилидином в присутствии мелкодисперсного порошка меди:
Мефенаминовая кислота обладает противовоспалительным, жаропонижающим и анальгезирующим действием, стимулирует заживление ран, стимулирует образование интерферона. Угнетает синтез медиаторов воспаления – простагландинов, серотонина, подавляет активность протеаз лизосом. Болеутоляющее действие связано с действием на центральные механизмы болевой чувствительности. Применяют при остром ревматизме, головной боли, невралгии, полиартрите, простудных и лихорадочных заболеваниях, зубной боли и при парадонтозе. В синтезе хлорпромазина (аминазина) проводят реакцию анилина с 2,4-дихлорбензойной кислотой. Синтез 2-хлорфенотиазина представлен на схеме:
В разделе 2.2.1 отмечалось, что 2,4-диметокси-6-аминопиримидин, который является промежуточным продуктом в синтезе сульфадиметоксина, не удается получить прямым метилированием аминоурацила. Синтез этого вещества осуществляют с применением реакций нуклеофильного замещения:
При замещении оксогрупп на хлор при действии оксотрихлорида фосфора в качестве катализатора используют диметиланилин. В производстве сульфамонометоксина 4-амино-6-метоксипиримидин является полупродуктом. Более подробно технологические особенности реакций можно рассмотреть на его примере.
Малондиамид, предварительно полученный обработкой малонового эфира водным аммиаком, и формамид кипятят в метанольном растворе метилата натрия 2 ч, при этом образуется 4,6-диоксопиримидин, который выделяют после отгонки метанола и подкисления реакционной массы раствором HCl до рН 3. Высушенный диоксопиримидин смешивают с оксотрихлоридом фосфора, добавляют диметиланилин и смесь кипятят 3,5 ч, после охлаждения до 10 оС реакционную массу выливают в холодную воду, отфильтровывают осадок 4,6-дихлорпиримидина и промывают его водой до нейтральной реакции промывных вод. Далее ведут ступенчатую замену атомов хлора. Вначале обработкой водным раствором аммиака автоклаве при 50 оС получают 4-амино-6-хлорпиримидин. Затем кипячением в течение 7 часов в 10 % растворе едкого натра в безводном метаноле второй атом хлора в положении шесть пиримидинового цикла замещается на метоксигруппу и образуется целевой 4-амино-6-метоксипиримидин. Конечный продукт выделяют отгонкой метанола и охлаждением кубового остатка до 0 – 3 оС. Общий выход составляет лишь 36 % в пересчете на малондиамид. Тем не менее рассмотренный путь синтеза является наиболее оптимальным.
|
|||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 661; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.64.51 (0.014 с.) |