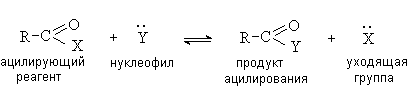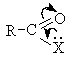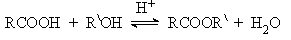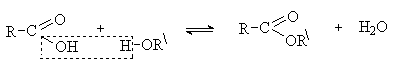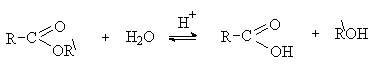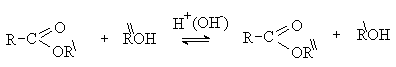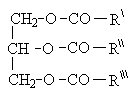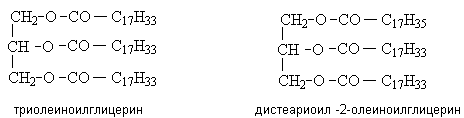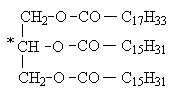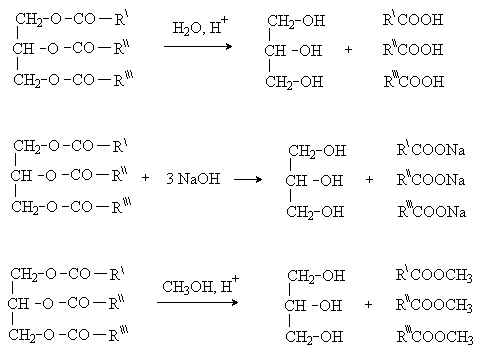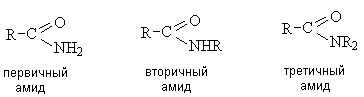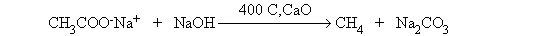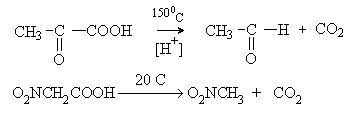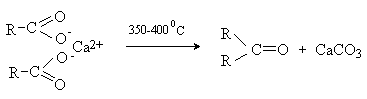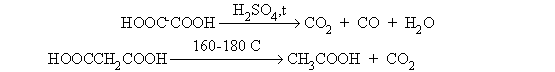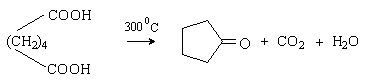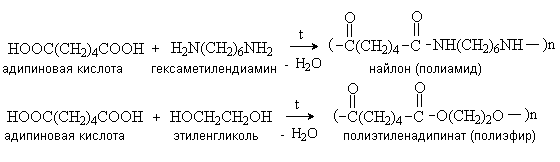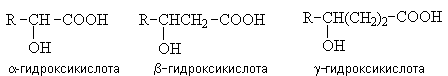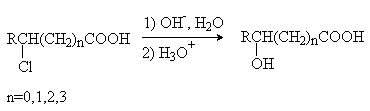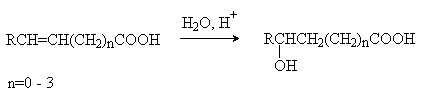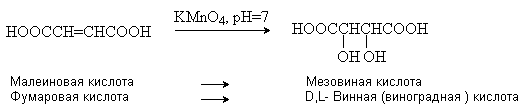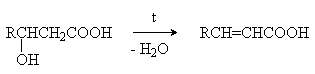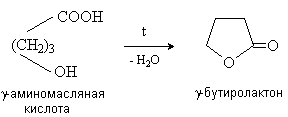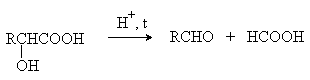Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реакции нуклеофильного замещения. Функциональные производные карбоновых кислот.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
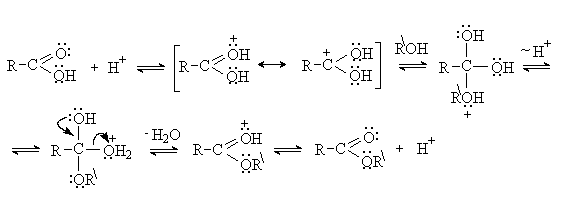
Основной тип реакций карбоновых кислот – взаимодействие с нуклеофилами с образованием функциональных производных. Взаимопревращения, связывающие карбоновые кислоты и их функциональные производные, приведены на схеме.
Представленные на схеме соединения содержат ацильную группу Ацилирование представляет собой процесс нуклеофильного замещения у карбонильного атома углерода. Реакционная способность по отношению к нуклеофилам у карбоновых кислот и их функциональных производных меньше, чем у альдегидов и кетонов, так как эффективный положительный заряд на карбонильном атоме углерода у них ниже за счет + М- эффекта группы Х.
По ацилирующей способности производные карбоновых кислот располагаются в следующий ряд в соответствии с уменьшением +М-эффекта группы Х.
В этом ряду предыдующие члены могут быть получены из последующих ацилированием соответствующего нуклеофила. Процесс получения более активных ацилирующих реагентов из менее активных практически не идет из-за неблагоприятного положения равновесия вследствие более высокой основности уходящей группы по сравнению с атакующим нуклеофилом. Все функциональные производные могут быть получены непосредственно из кислот и превращаются в них при гидролизе. Сложные эфиры Методы получения
RCOO-Na+ + RCl → RCOOR + NaCl Важнейшим методом получения сложных эфиров является реакция этерификации. Реакция протекает как нуклеофильное замещение в карбоксильной группе. Реакцию проводят в условиях кислотного катализа. Роль кислотного катализатора состоит в увеличении эффективного положительного заряда на атоме углерода карбоксильной группы: Реакции нуклеофильного замещения в алкоксикарбонильной группе. Сложные эфиры – более слабые ацилирующие реагенты, чем ангидриды и хлорангидриды. SN-реакции в алкоксикарбонильной группе протекают в более жестких условиях и требуют кислотного или основного катализа. Важнейшими реакциями этого типа являются гидролиз, аминолиз и переэтерификация. Гидролиз. Сложные эфиры гидролизуются с образованием карбоновых кислот под действием кислот или щелочей. Кислотный гидролиз сложных эфиров – это реакция обратная этерификации. RCOOR + NaOH → RCOO-Na+ + ROH
Переэтерификация. В реакции переэтерификации роль нуклеофила выполняет молекула спирта. Процесс катализируется кислотами или основаниями. Сложные эфиры ацилируют аммиак и амины с образованием амидов карбоновых кислот.
Триацилглицериды Триацилглицериды – это сложные эфиры глицерина и высших жирных кислот. Общая формула:
Простые триацилглицериды содержат остатки одинаковых, смешанные – разных жирных кислот. Названия триацилглицеридов строятся на основе названий ацильных остатков, входящих в их состав жирных кислот.
Смешанные триацилглицериды могут содержать хиральный атом углерода в положении 2 и иметь энантиомеры, например:
Триацилглицериды – малополярные, не растворимые в воде вещества. Триацилглицериды, содержащие преимущественно остатки ненасыщенных кислот, при обычных условиях являются жидкостями, насыщенных кислот – твердыми веществами. Они входят в состав животных жиров и растительных масел, которые представляют собой смеси триацилглицеридов. Животные жиры содержат в основном триацилглицериды с остатками насыщенных кислот и поэтому имеют твердую консистенцию. Растительные масла включают в основном остатки ненасыщенных кислот и являются жидкостями. Основная биологическая функция триацилглицеридов – запасные вещества животных и растений. Химические свойства триацилглицеридов определяются наличием сложноэфирной связи и ненасыщенностью. Как сложные эфиры триацилглицериды гидролизуются под действием кислот и щелочей, а также вступают в реакцию переэтерификации.
При щелочном гидролизе (омылении) жиров образуются соли жирных кислот (мыла). Их молекулы дифильны (содержат полярную “голову” и неполярный “хвост”), что обусловливает их повехностно-активные свойства и моющее действие. Триацилглицериды, содержащие остатки ненасыщенных жирных кислот, вступают в реакции присоединения по двойной связи.
Важным промышленным процессом является гидрогенизация жиров – каталитическое гидрирование растительных масел, в результате которого водород насыщает двойные связи, и жидкие масла превращаются в твердые жиры (маргарин). Наибольшей пищевой ценностью обладают растительные масла, которые наряду с незаменимыми жирными кислотами содержат необходимые для организма фосфолипиды, витамины, полезные фитостерины (предшественники витамина D) и практически не содержат холестерин.
Амиды карбоновых кислот
Строение амидной группы А мидная группа встречается во многих биологически важных соединениях, прежде всего в пептидах и белках (пептидная связь). Её электронное и пространственное строение во многом определяет их биологическое функционирование. Амидная группа представляет собой р-π -сопряженную систему, в которой происходит дополнительное перекрывание р-орбитали атома азота с π -орбиталью связи углерод-кислород.
Пептидная связь также имеет транс -конфигурацию, в которой боковые радикалы аминокислотных остатков наиболее удалены друг от друга 2.3. Реакции по α -углеродному атому Карбоновые кислоты, содержащие α -водородные атомы, взаимодействуют с бромом в присутствии фосфора с образованием α -бромпроизводных (реакция Гелля – Форгальда - Зелинского):
Галоген в α -галогензамещенных кислотах легко замещается под действием нуклеофильных реагентов. Поэтому α -галогензамещенные кислоты являются исходными веществами в синтезе широкого круга замещенных по α -положению кислот, в том числе α -амино- и α -гидроксикислот:
Декарбоксилирование Декарбоксилирование – это удаление CO2 из карбоновых кислот или их солей. Декарбоксилирование проводят путем нагревания в присутствии кислот или оснований. При этом, как правило, происходит замещение карбоксильной группы на атом водорода. Незамещенные монокарбоновые кислоты декарбоксилируются в жестких условиях:
Декарбоксилирование облегчается при наличии электроноакцепторных заместителей в α –положении:
Важное значение имеет ферментативное декарбоксилирование кето-, амино- и гидроксикислот в. Декарбоксилирование путем нагревания (сухой перегонки) кальциевых и бариевых солей карбоновых кислот – метод получения кетонов:
Восстановление. Карбоновые кислоты, хлорангидриды, ангидриды и сложные эфиры восстанавливаются LiAlH4 до первичных спиртов. Хлорангидриды могут быть восстановлены до альдегидов.
Дикарбоновые кислоты Дикарбоновые кислоты содержат две карбоксильные группы. Наиболее доступными являются кислоты линейного строения, содержащие от 2 до 6 атомов углерода. Их строение и методы получения представлены в таблице 9. Химические свойства дикарбоновых кислот в основном аналогичны свойствам монокарбоновых кислот. Они дают все реакции, характерные для карбоксильной группы. При этом могут быть получены функциональные производные (хлорангидриды, ангидриды, сложные, эфиры, амиды) как по одной, так и по обеим карбоксильным группам. Дикарбоновые кислоты имеют большую кислотность, чем монокарбоновые, вследствие –I-эффекта карбоксильной группы. По мере увеличения расстояния между карбоксильными группами кислотность дикарбоновых кислот уменьшается. Дикарбоновые кислоты имеют ряд специфических свойств, которые определяются наличием в молекуле двух карбоксильных групп. Отношение дикарбоновых кислот к нагреванию. Превращения дикарбоновых кислот при нагревании зависят от длины цепи, разделяющей карбоксильные группы, и определяются возможностью образования термодинамически стабильных пяти- и шестичленных циклов. При нагревании щавелевой и малоновой кислот происходит декарбоксилирование:
Янтарная, глутаровая и малеиновая кислоты при нагревании легко отщепляют воду с образованием пяти- и шестичленных циклических ангидридов:
Адипиновая кислота при нагревании декарбоксилируется с образованием циклического кетона – циклопентанона.
Реакции поликонденсации Д икарбоновые кислоты взаимодействуют с диаминами и диолами с образованием соответственно полиамидов и полиэфиров, которые используются в производстве синтетических волокон.
Биологически важные дикарбоновые кислоты. Щавелевая кислота образует труднорастворимые соли, например, оксалат кальция, которые отлагаются в виде камней в почках и мочевом пузыре. Янтарная кислота участвует в обменных процессах, протекающих в организме. Является промежуточным соединением в цикле трикарбоновых кислот. Фумаровая кислота, в отличие от малеиновой, широко распространена в природе, участвует в процессе обмена веществ, в частности в цикле трикарбоновых кислот. Лекция № 14 ГИДРОКСИ- И ОКСОКИСЛОТЫ План Большинство биологически важных органических соединений (метаболиты, биорегуляторы, структурные элементы биополимеров, лекарственные средства) являются гетерофункциональными соединениями. Наиболее важные из них - гидрокси-, оксо- и аминокислоты. Гидроксикислоты
Гидроксикислоты – гетерофункциональные соединения, содержащие карбоксильную и гидроксильную группы. По взаимному расположению функциональных групп различают α -,ß -, γ - и т.д. гидроксикислоты.
В природе широко распространены полигидроксикарбоновые кислоты (содержат нескольно гидроксильных групп) и гидроксиполикарбоновые кислоты (содержат несколько карбоксильных групп). Методы получения 1) Гидролиз галогензамещенных кислот.
2) Взаимодействие аминокислот с азотистой кислотой.
3) Восстановление оксокислот.
4) Присоединение воды к непредельным кислотам.
5)Циангидринный синтез.
6) Окисление непредельных кислот.
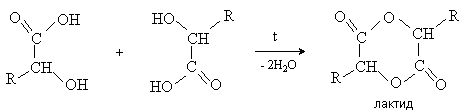
Химические свойства. Гидроксикислоты дают реакции, характерные для карбоновых кислот и спиртов, при этом могут участвовать как одна, так и обе функции. Гидроксикислоты имеют ряд специфических свойств, обусловленных присутствием обеих групп и их взаимным расположением. Отношение гидроксикислот к нагреванию. Превращения гидроксикислот при нагревании определяются возможностью образования термодинамически стабильных 5-ти- и 6-тичленных циклов. α -Гидроксикислоты образуют циклические сложные эфиры – лактиды.
ß -Гидроксикислоты при нагревании переходят α,ß-непредельные кислоты.
γ,δ-Гидроксиокислоты претерпевают внутримолекулярное ацилирование с образованием циклических сложных эфиров – лактонов.
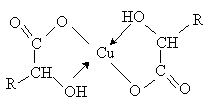
Специфические реакции α -гидроксикислот. α -Гидроксикислоты образуют хелатные комплексы с ионами переходных металлов (Cu2+, Fe3+ и др.), которые содержат металл в составе устойчивого 5-тичленного цикла.
В присутствии минеральных кислот α -гидроксикислоты разлагаются с образованием муравьиной кислоты и соответствующего альдегида.
|
||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 2804; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.254.177 (0.006 с.) |


 . В ходе их взаимопревращений она в неизменном виде переходит из одного соединения в другое, соединяясь с нуклеофилом. Такие процессы называют ацилированием, а карбоновые кислоты и их функциональные производные – ацилирующими реагентами. В общем виде процесс ацилирования может быть представлен следующей схемой:
. В ходе их взаимопревращений она в неизменном виде переходит из одного соединения в другое, соединяясь с нуклеофилом. Такие процессы называют ацилированием, а карбоновые кислоты и их функциональные производные – ацилирующими реагентами. В общем виде процесс ацилирования может быть представлен следующей схемой: