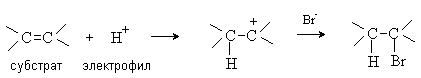Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гомолитические реакции – реакции, в которых разрыв связи происходит симметрично, так что каждому из образующихся фрагментов отходит по одному электрону.Содержание книги
Поиск на нашем сайте A: B → A.+ B. В ходе гомолитических реакций в качестве интермедиатов образуются свободные радикалы – частицы, содержащие неспаренный электрон, например:
Синхронные реакции – это особый тип реакций, в которых разрыв старых и образование новых связей происходят одновременно за счет согласованного перемещения электронов в циклическом комплексе. Примером таких реакций может служить реакция Дильса-Альдера:
Взаимодействующие в органической реакции вещества подразделяют на реагент и субстрат. При этом считается, что реагент атакует субстрат. Субстратом, как правило, считают молекулу, которая предоставляет атом углерода для новой связи. Например, в реакции (1) алкен является субстратом, а молекула брома реагентом. По типу реагента реакции делятся на электрофильные (Е), нуклеофильные (N) и радикальные (R). В нуклеофильных реакциях реагент ( нуклеофил) имеет на одном из атомов свободную пару электронов и является нейтральной молекулой или анионом (Hal-, OH-, RO-, RS-, RCOO-, R-, CN-, H2O, ROH, NH3, RNH2 и др.). Все нуклеофилы – основания Льюиса. Нуклеофил атакует в субстрате атом с наименьшей электронной плотностью (т.е. с частичным или полным положительным зарядом). При этом новая связь образуется за счет электронной пары нуклеофила, а старая претерпевает гетеролитический разрыв. Примером нуклеофильной реакции может служить нуклеофильное замещение (символ SN) у насыщенного атома углерода:
В электрофильных реакциях атакующий реагент (электрофил) имеет вакантную орбиталь и является нейтральной молекулой или катионом (Cl2, SO3, BF3, H+, Br+, R+, NO2+, и др.). Все электрофилы – кислоты Льюиса. Электрофил атакует в субстрате атом с наибольшей электронной плотностью, причем старая связь претерпевает гетеролитический распад, а образование новой связи происходит за счет пары электронов субстрата. Пример электрофильной реакции – электрофильное присоединение (символ AE) к С=С связи:
В радикальных реакциях реагент имеет неспаренный электрон и является свободным радикалом (CI., R, и др.). В ходе радикальных реакций связь в субстрате разрывается гомолитически, а новая связь образуется за счет неспаренного электрона свободного радикала и одного из электронов старой связи. Примером радикальных реакций может служить радикальное замещение (символ SR) в алканах: R-H + CI, →→→→ R, + HCI R, + CI-CI → R-CI + CI, В зависимости от числа частиц, участвующих в элементарных реакциях, различают мономолекулярные и бимолекулярные реакции. Часто разные способы классификации используют в сочетании друг с другом. Например, далее будут рассмотрены реакции мономолекулярного и бимолекулярного нуклеофильного замещения (символы SN1 и SN2), мономолекулярного и бимолекулярного элиминирования (символы Е1 и Е2) и др. Лишь незначительное число органических реакций являются элементарными. Большинство из них являются сложными и состоят из нескольких последовательных или параллельных элементарных стадий. В последовательных реакциях продукт одной элементарной реакции является исходным веществом для другой, например:
В ходе таких реакций образуются промежуточные соединения (интермедиаты), которые не входят в суммарное уравнение. В приведенной реакции таким интермедиатом является В. Интермедиаты в органических реакциях – это, как правило, высокореакционноспособные частицы – карбокатионы, карбоанионы, свободные радикалы. Энергетическая диаграмма реакции, протекающей через образование интермедиата представлена на рисунке.
Энергетическая диаграмма содержит два максимума, которые соответствуют переходным состояниям Х1 и Х2. Образование интермедиата В протекает через переходное состояние Х1, которому соответствует достаточно высокая энергия активации Еа1. Благодаря высокой реакционной способности интермедиат В с небольшой энергией активации Еа2 (переходное состояние Х2) превращается в стабильный конечный продукт D. Таким образом, стадия образования интермедиата является медленной (лимитирующей) и определяет скорость процесса в целом. Выделение в механизме реакций скорость-определяющей стадии имеет принципиальное значение, поскольку все факторы, влияющие на эту стадию, аналогичным образом влияют на скорость реакции в целом. При оценке влияния различных факторов на скорость реакции оценивают их влияние на энергии исходного и переходного состояний скорость-определяющей стадии. Факторы, стабилизирующие переходное состояние в большей степени, чем исходное, уменьшают энергию активации и увеличивают скорость реакции, и наоборот. Переходные состояния имеют практически нулевое время жизни, поэтому их структуру нельзя определить экспериментально. Она может быть оценена теоретически, путем сравнения их с реальными частицами, близкими к ним по энергии. Такими частицами могут быть интермедиаты, которые можно рассматривать как модели переходных состояний.
|
||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 461; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.62 (0.006 с.) |