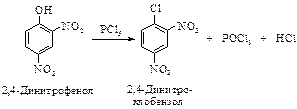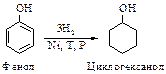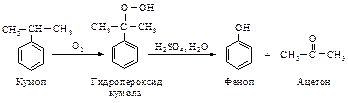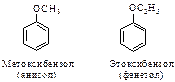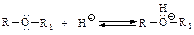Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Замещение гидроксигруппы в нитрофенолахСодержание книги
Поиск на нашем сайте Связь атома кислорода с атомом углерода ароматического кольца обладает высокой прочностью из-за сопряжения неподеленной электронной пары кислорода с p-электронами кольца. Фенолы в отличие от спиртов не превращаются в арилгалогениды при нагревании с галогенводородными кислотами и при действии галогенидов фосфора. Только фенолы, содержащие нитрогруппы в орто - или пара -положениях к гидроксильной группе, взаимодействуют с РСl5.
Окисление Фенолы чувствительны к действию окислителей. Под действием хромовой кислоты фенол и гидрохинон окисляются до п -бензохинона, а пирокатехин до о- бензохинона.
Резорцин (м -дигидроксифенол), а также фенолы сложного строения окисляются с образованием сложных смесей в результате димеризации и диспропорционирования. Фенолы, содержащие разветвленные алкильные группы в орто -положении к группе ОН, применяют в качестве антиоксидантов, стабилизаторов полимерных материалов. Такие фенолы легко образуют очень устойчивые (малореакционноспособные) радикалы, вызывая тем самым обрыв радикально-цепных окислительных реакций.
Восстановление Фенолы гидрируются водородом над никелевым катализатором в соответствующие циклогексанолы. В значительных количествах в промышленности гидрированием фенола получают, в частности, циклогексанол, применяемый в производстве полимерных материалов, например полиамида «найлон-6,6» (см. п. 10.2).
Способы получения Взаимодействие хлорбензола с водным раствором едкого натра при повышенной температуре и давлении
2.3.2. Разложение гидропероксида кумола водным раствором кислоты (реакция Сергеева-Удриса)
Щелочной плав сульфонатов
Гидролиз солей диазония
ПРОСТЫЕ ЭФИРЫ Простыми эфирами называются соединения общей формулы R-О-R, R-О-Ar. Если оба радикала одинаковы, эфир называют симметричным; если радикалы разные – несимметричным. Низшие простые эфиры называют по радикально-функциональной номенклатуре.
Простые эфиры сложного строения рассматривают как алканы или арены, в которых атом водорода замещен алкоксидной группой – алкоксиалканы или алкоксиарены:
Для некоторых ароматических эфиров часто применяют и тривиальные названия (даны в скобках)
Физические свойства Простые эфиры являются бесцветными жидкостями (кроме диметилового эфира, который в нормальных условиях является газообразным) и имеют своеобразный запах. Простые эфиры имеют более низкие температуры кипения, чем спирты, так как в эфирах отсутствуют межмолекулярные водородные связи. По той же причине простые эфиры (кроме диметилового эфира) плохо растворимы в воде. Простые эфиры менее полярны, чем спирты, их дипольный момент составляет (4,0-4,3)∙10-30 Кл∙м. Химические свойства Простые эфиры отличаются низкой реакционной способностью. Они устойчивы к действию сильных оснований, восстановителей и разбавленных кислот. В частности, эфиры не вступают в реакции с NaOH/Н2О, CH3MgI, Na, LiAlH4. Химическая инертность простых эфиров обусловливает их широкое применение в качестве растворителей в химических реакциях. Основность. Простые эфиры являются довольно слабыми основаниями и плохими нуклеофилами. Простые эфиры взаимодействуют с концентрированной серной кислотой, превращаясь при низкой температуре в кристаллические оксониевые соли.
Диэтиловый эфир используют в качестве растворителя в синтезах Гриньяра. Расщепление галогеноводороднымикислотами. Разрыв связи углерод-кислород происходит только в жестких условиях – при нагревании с концентрированными галогеноводородными кислотами НХ: HI > НВг > НС1 реакционная способность уменьшается Реакция представляет собой нуклеофильное замещение в протониро-ванном эфире, более реакционноспособном, чем нейтральная молекула эфира (сравните с реакцией замещения в спиртах).
Реакция протекает по механизму SN1 или SN2 в зависимости от строения алкильных групп. Реакции расщепления эфиров, содержащих первичные и вторичные алкильные группы, протекают по механизму SN2. Простые эфиры, содержащие третичную алкильную группу, расщепляются преимущественно по механизму SN1. Расщепление эфира может протекать и одновременно по двум механизмам - SN1 и SN2, что приводит к смеси двух алкилгалогенидов и двух спиртов. Расщепление арилалкиловых эфиров Ar-O-Alk всегда протекает только по связи ArO-Alk с образованием алкилгалогенида и фенола. Примеры: Реакции бимолекулярного нуклеофильного замещения
|
||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 518; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.006 с.) |