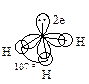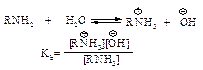Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Нитрование алканов. Реакция коноваловаСодержание книги
Поиск на нашем сайте
Известно несколько способов нитрования алканов. По жидкофазному способу алканы нитруют разбавленной азотной кислотой, с массовой долей 40-50 %.
По парофазному способу алканы нитруют в парах при температуре 350-500 оС.
В этих условиях реакция протекает менее селективно и сопровождается крекингом алкана. Нитрование ароматических соединений
Производные бензола, содержащие электронодонорные заместители, нитруются мягкими нитрующими агентами (смесь HNO3 + CH3COOH, ацетилнитрат CH3COONO2, разбавленная HNO3) при пониженной температуре. Производные бензола, содержащие электроноакцепторные заместители, нитруют в более жестких условиях, применяя нитрующую смесь с малым содержанием воды (HNO3 + H2SO4) и повышенную температуру. Замещение галогена на нитрогруппу в галогеналканах Удобным лабораторным методом получения первичных нитроалканов является реакция нуклеофильного замещения галогена нитрит-ионом. R–X + NaNO2 → R–NO2 + NaX По этой схеме, например, можно получить нитропропан и нитрометан.
Синтез с использованием солей диазония Нитроарены можно получить реакцией соли диазония с нитритом натрия и солью одновалентной меди Cu+ (реакция Зандмейера). АМИНЫ Амины – производные аммиака NH3. В соответствии с числом алкильных или арильных групп, связанных с азотом, различают первичные R–NH2, ArNH2; вторичные R1–NH–R2, R–NH–Ar; третичные амины В зависимости от природы углеводородных заместителей аминыбывают алифатические, ароматические и алкилароматические. Алифатические амины:
Ароматические амины:
Алкилароматические амины:
Строение и физические свойства В молекуле аммиака атом азота находится в sp3 -гибридном состоянии. Три гибридные орбитали перекрываются с s-орбиталями атомов водорода, образуя s-связи, четвертая содержит неподеленную пару электронов.
Поскольку амины – производные аммиака, в которых один или более атомов водорода замещены на алкильные группы, то можно предположить, что они имеют аналогичное строение. Если аммиак связан с тремя разными группами, то молекула не может быть совмещена с другой, являющейся ее зеркальным изображением, следовательно, она хиральна.
Однако эти энантиомеры никогда не были обнаружены. Энергетический барьер для превращения одной пирамидальной конфигурации в другую составляет всего 25,12 кДж/моль. Простейшие алифатические амины – метиламин, диметиламин и триметиламин – газы, хорошо растворимые в воде и обладающие аммиачным запахом. Остальные низшие амины – жидкости с запахом аммиака. Более сложные амины – жидкости с неприятным запахом рыбы. Высшие амины – твердые, не растворимые в воде вещества, лишенные запаха. При равном числе атомов углерода наиболее высокая температура кипения у первичных аминов, несколько ниже у вторичных и третичных. Ароматические амины – жидкости или твердые тела с характерным неприятным запахом, сильно токсичны. В воде растворяются мало, накопление аминогрупп ведет к увеличению растворимости. Химические свойства Многие химические свойства аминов обусловлены стремлением аминов обобществить неподеленную пару электронов азота с протоном, благодаря чему они являются основаниями, либо с электронодефицитным атомом другой молекулы, что определяет их способность выступать в качестве нуклеофильных реагентов. Основность Образование солей аммония при действии водных растворов минеральных кислот свидетельствует о том, что амины – более сильные основания, чем Н2О.
Амины вытесняются из солей аммония при действии гидроксид-иона, т.е. амины более слабые основания, чем гидроксид-ион.
Основность убывает в ряду ОНy>RNH2>H2O. По аналогии с кислотностью основность аминов удобно сравнивать, определяя степень переноса протона с воды на амин.
Чем больше константа основности Кb, тем сильнее основание. Константа основности Kb для всех трех классов алифатических аминов 10–3–10–4, т.е. алифатические амины более сильные основания, чем аммиак Kb=1,8∙10-5. Для ароматических аминов Kb<10–9. Структура и основность. Наличие заместителей оказывает сильное влияние на основность. Алифатические амины – более сильные основания, чем аммиак.
Основность алифатических аминов увеличивается в ряду NH3<R1NH2<R1–NH–R2. Ароматические амины более слабые основания, чем аммиак. Пара электронов азота обобществлена с электронами кольца и поэтому менее доступна для образования связи с ионом водорода.
|
||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 1236; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.121.79 (0.006 с.) |



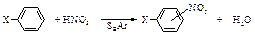



 .
.