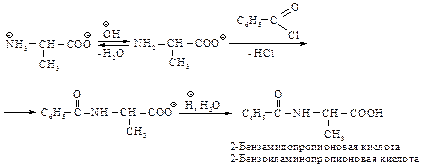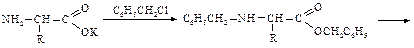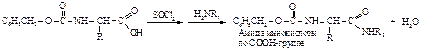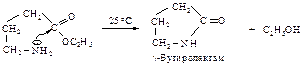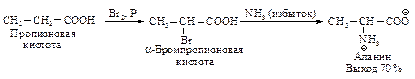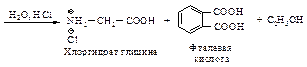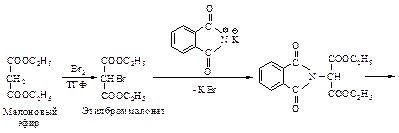Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
A,b-Непредельные карбонильные соединенияСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Соединения, содержащие двойную углерод-углеродную связь и карбонильную группу: проявляют свойства, характерные для обеих функциональных групп. В качестве непредельных соединений они вступают в реакции электрофильного присоединения галогенов, галогеноводородов, воды, спиртов, а по карбонильной группе – вступают в реакции нуклеофильного замещения (эфиры, кислоты) или присоединения (альдегиды, кетоны). В a,b-непредельных карбонильных соединениях две двойные связи углерод-кислород и углерод-углерод разделены одной простой связью, т.е. двойные связи являются сопряженными. Вследствие этого электроны двойных связей углерод-углерод и углерод-кислород действует как единая p-электронная система. Электрофильное присоединение. Карбонильная группа, проявляющая электроноакцепторные эффекты (-М, -I), уменьшает реакционную способность двойной связи углерод-углерод по отношению к электрофилу и одновременно определяет направление электрофильного присоединения.
Механизм. При электрофильном присоединении в медленной стадии реакции в соответствии с правилом Марковникова образуется наиболее устойчивый карбокатион. Первая стадия. Как и в случае сопряженных диенов, присоединение электрофила НÅ будет происходить преимущественно по концевому атому сопряженной p-электронной системы, т.к. в этом случае образуется аллильный карбокатион, стабилизированный распределением двух p-электронов по орбиталям трех атомов.
В случае присоединения протона к атому кислорода образуется карбокатион (I) – более устойчивый, т.к. положительный заряд распределен только на атомах углерода, в то время как в катионе (II) положительный заряд распределен с участием электроотрицательного атома кислорода. Вторая стадия – присоединение нуклеофила.
Нуклеофил Zy может присоединяться к обоим атомам, несущим положительный заряд, однако осуществляется только присоединение к b-углеродному атому, т.к. при этом образуется стабильный продукт (III), представляющий собой енольную форму карбонильного соединения. Его таутомер и является продуктом реакции (V). Соединение (IV) не образуется, поскольку оно очень неустойчиво: два сильноэлектроотрицательных атома связаны с одним углеродом, отщепление одного из них приводит к исходному соединению. Например, в случае окиси мезитила Zy = yОСН3:
в случае кротоновой кислоты Zy = Bry:
Нуклеофильное присоединение. Электроноакцепторные группы
Механизм. Первая стадия состоит во взаимодействии нуклеофила с образованием устойчивого сопряженного аниона (I), в котором отрицательный заряд распределен с участием электроотрицательного кислорода.
Во второй стадии анион (I) присоединяет протон от растворителя к a-углероду, при этом образуется кетон (II), и к кислороду, давая енол (III), который перегруппировывается в тот же кетон (II).
Таким образом, электрофильное и нуклеофильное присоединение к a,b-непредельным карбонильным соединениям следует рассматривать как присоединение реагента к концевому атому единой сопряженной системы с образованием наиболее устойчивого иона.
Присоединение карбанионов к a,b-ненасыщенным карбонильным соединениям называется присоединением поМихаэлю. Примером может служить реакция присоединения диэтилмалоната к этиловому эфиру коричной кислоты.
Помимо аниона малонового эфира в качестве нуклеофильных реагентов можно использовать нитрил малоновой кислоты, ацетоуксусный и цианоуксусный эфиры, все они образуют устойчивые карбанионы. Аминокислоты Аминокислоты содержат карбоксильную и аминогруппы. Аминокислоты, в которых первичная аминогруппа находится в a-положении по отношению к карбоксильной, называются a-аминокислотами. Они играют важную роль в жизни живых организмов, так как белки с химической точки зрения являются полимерами, образованными из нескольких сотен или даже тысяч остатков a-аминокислот. В таблице 10 приведены некоторые аминокислоты. Кофигурация аминокислот Каждая a-аминокислота, за исключением глицина, содержит асимметрический a-углеродный атом. Аминокислоты, получающиеся в результате гидролиза белков, являются оптически активными, и все они имеют одинаковую конфигурацию по a-углеродному атому.
Кислотно-основные свойства Многие свойства аминокислот, как физические, так и химические, не согласуются с формулой R–CH(NH2)–COOH. Аминокислоты в противоположность карбоновым кислотам и аминам представляют собой нелетучие кристаллические вещества, которые плавятся с разложением при высокой температуре. Они не растворимы в неполярных растворителях, но заметно растворяются в воде. Таблица 10 Аминокислоты
Константы кислотности и основности для групп –СООН и –NH2 очень малы. Для большинства карбоновых кислот Ка~10 -5, для алифатических аминов Кb~10 4, в то же время для глицина Ка=1,6·10–10, а Кb=2,5·10–12. Их водные растворы ведут себя как растворы веществ с высоким дипольным моментом. Все эти свойства могут быть объяснены, если аминокислоты представить как диполярные ионы (цвиттер-ионы)
Константа основности относится к основности карбоксилат-иона
При подщелачивании раствора аминокислоты диполярный ион (I) превращается в анион (II), если подкислить раствор аминокислоты, то диполярный ион (I) превращается в катион (III).
Диполярный ион (I) находится в равновесии с ионами (II) и (III), содержащими свободную амино- или карбоксигруппу, поэтому a-аминокислоты вступают в реакции, характерные для аминов и карбоновых кислот. Реакцию амина или кислоты можно ускорить, изменяя кислотность среды и тем самым увеличивая концентрацию иона (II) или (III). Если раствор аминокислоты поместить в электрическое поле, то в сильно кислых растворах аминокислота в виде катиона Реакции, в которые вступают амины и карбоновые кислоты, характерны и для аминокислот. Реакцию проводят в той среде, которая обеспечивает высокую концентрацию реагирующей группы. Например, ацилирование аминокислоты по аминогруппе следует проводить в основной среде.
Следует учитывать, что реакции аминокислот могут усложняться из-за того, что в превращениях одной функциональной группы может принимать участие и другая. Для того, чтобы это предотвратить, во время реакции по одной группе другая должна быть защищена. Реакции по аминогруппе. Свободные аминокислоты, как и первичные алифатические амины, реагируют с азотистой кислотой с выделением азота. По количеству выделившегося азота определяют содержание аминогрупп.
Аминокислоты могут быть проалкилированы по аминогруппе. Например, N-бензиламинокислоту получают, обрабатывая бензилхлоридом соль аминокислоты; полученный в результате N-бензилзамещенный бензиловый эфир подвергают гидролизу.
Ацилирование аминокислот по аминогруппе протекает достаточно легко.
Получение N-ацильных производных используют как метод защиты аминогруппы при проведении реакций по карбоксильной группе. При этом следует принимать во внимание легкость снятия защиты – отщепления защищающей группы. Примером соединения, которое используется для блокирования аминогруппы, является бензилхлоркарбонат (или бензилоксикарбонилхлорид).
После проведения реакции по карбоксильной группе блокирующую группу удаляют гидрированием.
Реакции при нагревании. Подобно тому, как при циклизации оксикислот образуются лактоны, при циклизации b,g-аминокислот образуются лактамы. g-Бутиролактам образуется при нагревании этил-g-аминобутирата.
Поведение a-, b-аминокислот также аналогично поведению a-, b-оксикислот. При нагревании этил-a-аминобутирата образуется димерный диэтилдикетопиперазин.
Этил-b-аминобутират при нагревании превращается в ненасыщенное соединение.
Способы получения Аминирование a-галогенкислот - наиболее общий метод синтеза a-аминокислот. a-Галогензамещенные кислоты (см. п. 6.2.3) подвергают прямому аминолизу, используя большой избыток концентрированного водного аммиака.
Подвергаемую аминолизу галогензамещенную кислоту можно получить при помощи малонового эфира (см. п. 10.2).
Выходы значительно выше при использовании синтеза по Габриэлю (см. п. 10.2), при этом вместо a-галогензамещенных кислот следует использовать a-галогенэфиры.
Фталимидмалоновый синтез является комбинацией синтеза при помощи малонового эфира и реакции Габриэля.
Все эти методы синтеза приводят к получению рацемической смеси энантиомеров a-аминокислот.
Библиографический список
1. Моррисон, Р. Органическая химия. – М.: Мир, 1974. – 1132 с. 2. Терней, А. Современная органическая химия: 2 т. – М.: Мир, 1991. – Т. 1. – 670 с.; Т. 2. – 615 с. 3. Робертс, Дж. Основы органической химии: в 2 т. / Дж. Моррисон, М. Кассерио. – 2-е изд. – М.: Мир, 1978. – Т. 1. – 842 с.; Т. 2. – 888 с. 4. Шабаров, Ю. С. Органическая химия: в 2 кн. – М.: Химия, 1994. – 848 с. 5. Травень, В. Ф. Органическая химия: 2 т. – М.: ИКЦ Академкнига, 2004. – Т. 1. – 727 с.; Т. 2. – 582 с. О Г Л А В Л Е Н И Е
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 588; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.219.207.115 (0.014 с.) |




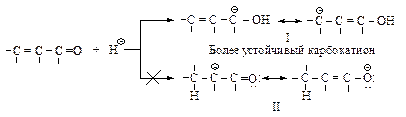



 дезактивируют двойную углерод-углеродную связь при взаимодействии с электронодефицитными реагентами – в реакциях электрофильного присоединения, в то же время активируют двойную связь по отношению к реагентам, которые богаты электронами (нуклеофилам), – в реакциях нуклеофильного присоединения.
дезактивируют двойную углерод-углеродную связь при взаимодействии с электронодефицитными реагентами – в реакциях электрофильного присоединения, в то же время активируют двойную связь по отношению к реагентам, которые богаты электронами (нуклеофилам), – в реакциях нуклеофильного присоединения.



 Положительный заряд распределен между атомами углерода
Положительный заряд распределен между атомами углерода
 Отрицательный заряд распределен с участием электроотрицательного кислорода
Отрицательный заряд распределен с участием электроотрицательного кислорода
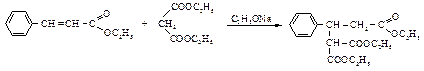



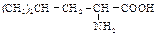




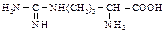

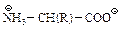 . Высокаятемпература плавления, растворимость, высокий дипольный момент соответствуют свойствам соединений с такой структурой. Несоответствие констант кислотности и основности ожидаемым для кислот и аминов также становится понятным. Измеряемая константа кислотности относится к кислотности иона аммония
. Высокаятемпература плавления, растворимость, высокий дипольный момент соответствуют свойствам соединений с такой структурой. Несоответствие констант кислотности и основности ожидаемым для кислот и аминов также становится понятным. Измеряемая константа кислотности относится к кислотности иона аммония  .
.

 .
.


 будет перемещаться к катоду, а в сильнощелочных – в виде аниона
будет перемещаться к катоду, а в сильнощелочных – в виде аниона  – к аноду. При определенном значении рН, характерном для данной аминокислоты, она не будет мигрировать ни к аноду, ни к катоду, так как при этом она будет представлять собой нейтральный биполярный ион. Это значение рН называется изоэлектрической точкой (рI).
– к аноду. При определенном значении рН, характерном для данной аминокислоты, она не будет мигрировать ни к аноду, ни к катоду, так как при этом она будет представлять собой нейтральный биполярный ион. Это значение рН называется изоэлектрической точкой (рI).