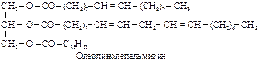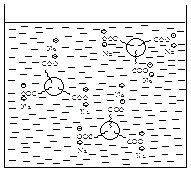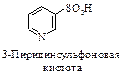Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Восстановление производных кислотСодержание книги
Поиск на нашем сайте
Сложные эфиры, ангидриды и хлорангидриды восстанавливаются с помощью литийалюминийгидрида с образованием первичных спиртов.
Способы получения и свойства карбоновых кислот приведены на рис. 4.
8. Жиры. Воски Жиры представляют собой полные сложные эфиры трехатомного спирта – глицерина с алифатическими (жирными) кислотами. Жиры называют также триглицеридами (или триацилглицеридами).
Химические, физические и биологические свойства жиров определяются входящими в его состав триглицеридами, и в первую очередь, длиной цепи, степенью ненасыщенности жирных кислот и их расположением в триглицериде. В состав жиров входят в основном неразветвленные жирные кислоты, содержащие четное число атомов С (от 4 до 26), как насыщенные, так моно- и полиненасыщенные; в основном это лауриновая (додекановая), миристиновая (тетрадекановая), пальмитиновая (гексадекановая), стеариновая (октадекановая), 9-гексадеценовая, олеиновая (9-октадеценовая), линолевая (9,12-октадекадиеновая) и линоленовая (9,12,15-октадекатриеновая) кислоты. Почти все ненасыщенные кислоты растительных жиров и большинства животных жиров являются цис -изомерами. В зависимости от состава различают простые триглицериды, содержащие одинаковые кислотные остатки, и смешанные триглицериды с остатками различных кислот.
Некоторые природные жиры при комнатной температуре – твердые вещества, а другие – жидкие. Температура затвердевания жира обусловлена характером кислот, входящих в состав жира: чем больше содержание насыщенных кислот, тем она выше. Жидкие жиры называются маслами. Они состоят главным образом из глицеридов непредельных кислот – олеиновой, линолевой и линолиновой. Льняное, конопляное и тунговое масла содержат главным образом триглицериды кислот с двумя или тремя двойными связями (линолевой, линоленовой). Характерной особенностью этих масел является их способность на свету под действием воздуха в тонком слое высыхать, образуя твердую эластичную пленку. При высыхании происходят сложные химические реакции полимеризации с участием кислорода. Среди реакций жиров особое значение имеет гидролиз или омыление, которое можно осуществить как кислотами, так и основаниями. Полученные в результате щелочного гидролиза соли высших карбоновых кислот представляют собой мыла. В наибольших количествах производятся натриевые и калиевые мыла.
Некоторое представление об очищающем действии мыла можно получить из следующей картины. Полярный конец молекулы мыла -СООyNaÅ растворим в воде, а неполярный конец, состоящий из 12-18 атомов углерода, растворим в масле. Из-за наличия отрицательно заряженных карбоксилатных групп каждая капля масла окружена ионной оболочкой. Одинаковые заряды удерживают эти капли от слияния, при этом образуется устойчивая эмульсия масла в воде. Очищающее действие мыла обусловлено тем, что оно эмульгирует жир и сало, содержащие грязь (рис. 5).
Рис. 5. Очищающее действие мыла Твердые жиры устойчивы в хранении. Поэтому жидкие растительные масла часто подвергают отверждению. Этот процесс заключается в гидрировании (Ni, 200 оС, 0,2-1,5 МПа (2-15 атм)) двойных связей ненасыщенных карбоновых кислот в молекулах триглицеридов. Как правило, проводят лишь частичное гидрирование, сохраняя часть двойных связей в углеводородных фрагментах незатронутыми. Это позволяет избежать чрезмерного повышения температуры плавления гидрированного жира. Гидрированные жиры сходны во всех отношениях с природными твердыми жирами. Их используют для приготовления маргарина. Гидрирование растительных масел имеет нежелательное свойство: незатронутые при гидрировании двойные связи, имеющие цис -конфигурацию в природном растительном масле, приобретают транс -конфигурацию в гидрированном продукте. Полагают, что значительное употребление в пищу таких «транс -жиров» может стать причиной ряда сердечных и онкологических заболеваний. Воски – исторически сложившееся название разных по составу и происхождению продуктов, преимущественно природных, которые по свойствам близки пчелиному воску. Природные воски представляют собой пластичные, легко размягчающиеся при нагревании продукты, большинство из которых плавится в интервале температур 40-90 °С. Большинство природных восков содержит сложные эфиры одноосновных насыщенных карбоновых кислот нормального строения, таких как пальмитиновая, гексаэйкозановая или октаэйкозановая, и высших неразветвленных одноатомных спиртов с 12-46 атомами углерода в молекуле, например, 1-октадеканол (стеариловый) С17Н35СН2ОН, 1-триаконтанол (мирициловый) н-С29Н59СН2ОН или 9-октадеценол-1 СН3(СН2)7–СН=СН–(СН2)7СН2ОН. Типичным примером служит пчелинный воск, который содержит, в частности, мирициловый эфир пальмитиновой кислоты С15Н31СООС30Н61. Такие воски по химическим свойствам близки к жирам (триглицеридам), но омыляются только в щелочной среде. Иногда природные продукты, не содержащие сложные эфиры, например, парафин, называют аналогами воска или воскоподобными материалами. СУЛЬФОновые КИСЛОТЫ Сульфоновые кислоты (сульфокислоты) содержат функциональную группу – SO2OH. Сульфоновые кислоты классифицируют в зависимости от природы углеводородного радикала (ароматические, гетероциклические и алкансульфокислоты) и количества сульфогрупп.
Сульфоновые кислоты представляют собой сильно полярные соединения. Они лучше растворимы в воде, чем органические соединения других классов. Сульфогруппу –SO3H часто вводят в соединения, чтобы сделать их более растворимыми в воде. Сульфоновые кислоты мало летучи и разлагаются ниже температуры кипения. Они обычно вязки, и их трудно очищать. Поэтому сульфоновые кислоты удобно выделять и использовать в виде солей. Химические свойства Кислотность. Образование солей Cульфоновые кислоты полностью ионизированы в водных растворах. ArSO2OH → ArSO2Oy + HÅ Повышенная кислотность сульфоновых кислот вызвана тем, что отрицательный заряд в сульфонат-ионе распределен между тремя атомами кислорода.
Соли легко образуются при обработке сульфоновых кислот основаниями.
|
|||||||||||||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 250; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.148.112.15 (0.008 с.) |