
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Синтез с помощью реактива ГриньяраСодержание книги
Поиск на нашем сайте
Магнийорганические соединения (реактив Гриньяра) присоединяются к карбонильным соединениям по двойной связи углерод – кислород. Для синтеза первичных спиртов используют в качестве карбонильного соединения муравьиный альдегид. Для получения вторичных спиртов в качестве карбонильного соединения используют соответствующий альдегид. В случае синтеза третичных спиртов исходное карбонильное соединение – кетон.
Для получения первичных спиртов, содержащих на два атома углерода больше, чем в магнийорганическом исходном соединении, используют оксид этилена.
Третичные спирты можно также получить взаимодействием магнийгалогеналкилов со сложными эфирами. Реакция идет в две стадии: сначала происходит реакция замещения с образованием кетона, а затем в реакцию с кетоном вступает новая молекула магнийгалогеналкила.
Сложные эфиры муравьиной кислоты в этих условиях образуют вторичные спирты. Гидроборирование-окисление алкенов Алкенывзаимодействуют с дибораном В2Н6 с образованием алкилборана. Диборан - димер гипотетического борана ВН3 - в рассматриваемой реакции действует как ВН3.
Бор атакует атом углерода подобно протону в реакции гидратации - таким образом, что положительный заряд возникает на более алкилированном углероде, и при этом создается наиболее полная возможность для его распределения.
Бор, получающий p-электроны двойной связи алкена, передает водород с парой электронов на электронодефицитный углерод. Направление гидроборирования определяется тем же правилом, что и электрофильное присоединение: реакция протекает через образование наиболее устойчивой частицы. Триалкилбораны затем окисляют гидропероксидом в присутствии щелочи.
В реакции гидроборирования-окисления предпочтительным продуктом реакции будет не тот спирт, который образуется в реакции гидратации алкена. Восстановление карбонильных соединений Альдегиды восстанавливаются в первичные спирты, кетоны – во вторичные водородом в присутствии катализатора (Ni), при этом восстанавливается и двойная углерод-углеродная связь, или с помощью алюмогидрида лития LiAlH4, не затрагивая двойные углерод-углеродные связи.
Получение первичных спиртов восстановлением карбоновых кислот предпочтительно в том случае, когда кислоты более доступны, чем спирты.
Первичные спирты также могут быть получены восстановлением эфира, при этом оба фрагмента эфира превращаются в спирты.
Гидрированием окиси углерода в различных условиях можно получить как чистый метиловый спирт, так и смесь его первичных гомологов.
Брожение сахаров Дрожжи сбраживают некоторые виды сахаров. Это сложный каталитический многостадийный распад на спирт и диоксид углерода.
Способы получения и химические свойства спиртов приведены на рис. 1. Фенолы Фенолами называются соединения, в которых гидроксильная группа связана непосредственно с ароматическим ядром. Как и в случае спиртов, число ОН-групп определяет атомность фенолов. По числу гидроксильных групп в молекуле различают одно-, двух-, трех- и многоатомные фенолы:
Следует выделить особенности строения и свойства фенолов, в которых проявляются, с одной стороны, сходство со свойствами спиртов, а с другой - влияние ароматического кольца на реакционную способность гидроксильной группы и влияние гидроксильной группы на реакционную способность кольца. Физические свойства Простейшие фенолы – высококипящие жидкости или низкоплавкие твердые соединения. Они имеют высокие температуры кипения из-за обра-
зования водородных связей Фенол заметно растворим в воде, это объясняется образованием водородных связей с водой Фенолы - бесцветные вещества (за исключением нитрофенолов, имеющих желтый цвет), однако обычно окрашены за счет примесей продуктов их окисления кислородом воздуха. Физические свойства некоторых фенолов представлены в табл. 2. Высокая температура кипения п -нитрофенола обусловлена наличием межмолекулярных водородных связей. Из-за межмолекулярных связей м - и п -нитрофенолы образуют ассоциаты, и поэтому их нельзя перегнать с водяным паром.
У о -нитрофенола образуется в большей степени внутримолекулярная водородная связь, поэтому он не обладает свойствами ассоциированных жидкостей.
Внутримолекулярная водородная связь образуется всегда, когда это позволяет структура соединения.
Таблица 2 Физические свойства фенолов
Химические свойства Химические свойства фенолов определяются наличием в молекуле полярной группы -ОН. В основном эти реакции связаны с кислотностью фенола и электрофильным замещением в ядре. При этом атом кислорода всегда остается в молекуле. Для нуклеофильного замещения группы -ОН нужны очень жесткие условия, и эти реакции мало изучены. Следует отметить, что реакции нуклеофильного замещения с участием феноксид-иона идут легче, чем с участием фенола. Кислотность Фенолы более сильные кислоты, чем вода (Ка~10-16) и спирты (Ка~10-18), но значительно более слабые, чем карбоновые кислоты (Kа~10-5). Большинство фенолов имеют Ка~10-10. Гидроксигруппа, связанная с ароматическим ядром, является более кислой, чем группа ОН в воде и спирте, вследствие делокализации электронной пары феноксид-иона, изображенной с помощью граничных структур I - IV.
Ряд изменения кислотности и основности можно представить следующим образом: Относительная основность: Относительная кислотность: Влияние заместителей на кислотность фенолов
Повышенная кислотность фенолов по сравнению с водой и со спиртами проявляется в способности фенолов образовывать с водными растворами щелочей и спиртовыми растворами алкоксидов соли, называемые феноксидами (фенолятами).
Фенолы, в отличие от карбоновых кислот, не растворяются в водном растворе гидрокарбоната натрия, но их можно выделить из соли действием угольной кислоты
Нерастворимое в воде соединение, которое растворяется в водном растворе щелочи, но не растворяется в водном растворе гидрокарбоната, с большой долей вероятности является фенолом. Способность фенолов растворяться в водных растворах щелочей используют для выделения фенолов из смесей с нейтральными или менее кислыми соединениями, а также как качественную реакцию на фенол. Большинство фенолов (как и енолов) дают характерное окрашивание с водным и спиртовым раствором хлорида железа (III) FеС13 вследствие образования комплексных солей железа (цветная качественная реакция на фенолы). При этом фенол окрашивается в красно-фиолетовый цвет, крезол - в синий, резорцин - в темно-фиолетовый, а салициловая кислота
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 901; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.26.231 (0.01 с.) |





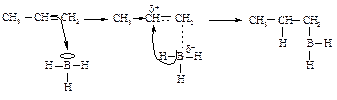




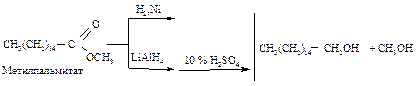



 . Более высокая температура кипения фенола (182 °С) по сравнению с температурой кипения циклогексанола (161 °С) также связана с тем, что в феноле прочнее водородные связи.
. Более высокая температура кипения фенола (182 °С) по сравнению с температурой кипения циклогексанола (161 °С) также связана с тем, что в феноле прочнее водородные связи. . Растворимость гомологов фенола ниже, двух- и трехатомных фенолов – выше.
. Растворимость гомологов фенола ниже, двух- и трехатомных фенолов – выше.





 G – электроноакцепторная группа: –NO2,–Hal,
G – электроноакцепторная группа: –NO2,–Hal,  ;
оттягивает электроны, способствует распределению заряда, уменьшает основность феноксид-иона, увеличивает кислотность
;
оттягивает электроны, способствует распределению заряда, уменьшает основность феноксид-иона, увеличивает кислотность
 G – электронодонорная группа: –СН3, –С2Н5;
подает электроны, увеличивает электронную плотность на кислороде, повышает основность феноксид-иона, уменьшает кислотность
G – электронодонорная группа: –СН3, –С2Н5;
подает электроны, увеличивает электронную плотность на кислороде, повышает основность феноксид-иона, уменьшает кислотность


 - в красный цвет.
- в красный цвет.


