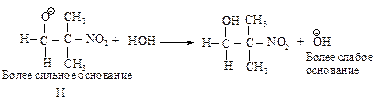Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Строение и физические свойстваСодержание книги
Поиск на нашем сайте
Нитрогруппа сильно полярна.
В каждой из граничных структур показана семиполярная связь – ковалентная донорно-акцепторная связь между азотом и кислородом, образованная за счет пары электронов только одного атома азота, вследствие чего оба атома получают заряды: атом кислорода, акцептор пары электронов – отрицательный, атом азота, донор пары электронов – положительный заряд.
Такое представление о строении нитросоединений согласуется с высокими значениями дипольных моментов нитросоединений (11,7-13,3)·10-30 Кл·м. Полярный характер нитросоединений приводит к меньшей летучести по сравнению с соединениями с близкой молекулярной массой. Несколько неожиданной является низкая растворимость нитрометана в воде – 10 г в 100 мл, а ацетон смешивается с водой во всех отношениях (табл. 7.). Таблица 7 Некоторые физические свойства нитрометана и ацетона
Нитроалканы представляют собой бесцветные жидкости с высокими для их молекулярных масс температурами кипения. Температура кипения нитрометана 101,2 оС; нитроэтана – 114 оС. Они обладают приятным запахом, перегоняются без разложения, мало растворимы в воде, ядовиты. Нитроалкены и нитроарены – жидкие или твердые вещества желтого цвета. Они тяжелее воды и не растворимы в ней. Эти нитросоединения имеют острый запах и высокотоксичны, особенно нитробензол. Химические свойства Термодинамическая неустойчивость нитросоединений. Молярная теплота разложения нитрометана около 270 кДж/моль. СН3NO2→ 1/2 N2 + CO2 + 3/2 H2 Значительная энергия и большая скорость такого процесса послужили основой для практического применения нитросоединений в качестве взрывчатых веществ. Восстановление нитросоединений до аминов – наиболее важная реакция для синтеза азотсодержащих соединений. Нитроалканы восстанавливают до алкиламинов оловом или железом в кислой среде, водородом в условиях гетерогенного катализа.
Реакция восстановления нитроаренов протекает гладко при действии олова или железа в соляной кислоте, а также водорода Н2 (Ni), гидросульфидов металлов, цинка в щелочной среде.
Реакция гидрирования очень экзотермична. В нейтральном или щелочном растворе активность восстанавливающих агентов по отношению к нитробензолу меньше, чем в кислом растворе. Восстановление в присутствии щелочи идет через следующие стадии:
В зависимости от условий восстановление можно остановить на одной из стадий. Например, восстановление цинком в водном растворе хлористого аммония дает фенилгидроксиламин, а при действии цинка в водно-спиртовом растворе гидроксида натрия анилин превращается в гидразобензол. Гидразобензол
Реакции с участием a-водородных атомов - наиболее важные реакции нитроалканов. Нитрометан обладает настолько сильными кислотными свойствами, что способен растворяться в едком натре.
Интересной особенностью этой соли является то, что при подкислении ее растворов образуется неустойчивый и обладающий очень сильными кислыми свойствами изомер нитрометана – ациформа, которая медленно превращается в нитрометан.
Первичные и вторичные нитросоединения вступают с карбонильными соединениями в реакции типа альдольной конденсации.
Механизм: Образование под влиянием основания карбаниона (I) – устойчивого сопряженного основания.
Далее происходит взаимодействие муравьиного альдегида с нуклеофилом (I) и образование промежуточного продукта (II).
Стабилизация промежуточного продукта (II) осуществляется за счет переноса протона от более слабого основания – гидроксид-иона к более сильному.
Способы получения
|
||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 300; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.202.60 (0.006 с.) |



 ∆Н= -356 кДж/моль
∆Н= -356 кДж/моль


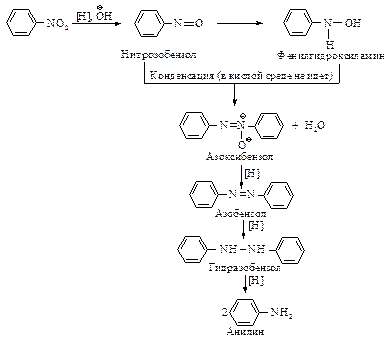
 в сильнокислой среде претерпевает необычную перегруппировку, приводящую к образованию бензидина – очень важного промежуточного продукта в синтезе красителей. Скорость перегруппировки пропорциональна квадрату концентрации протона.
в сильнокислой среде претерпевает необычную перегруппировку, приводящую к образованию бензидина – очень важного промежуточного продукта в синтезе красителей. Скорость перегруппировки пропорциональна квадрату концентрации протона.