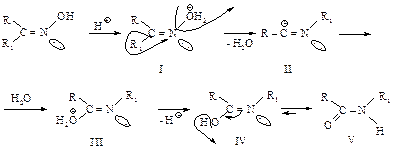Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Нуклеофильное присоединение синильной кислоты, бисульфита натрия, реактива Гриньяра, ацетиленидовСодержание книги
Поиск на нашем сайте
В карбонильном соединении атом углерода плоский, легко доступен для атаки нуклеофила сверху или снизу от этой плоскости (I).
В переходном состоянии (II) нуклеофил, подавая электроны на атом углерода, начинает образовывать с ним s-связь, а кислород приобретает электроны, атом углерода становится близок к тетраэдрическому. Продукт реакции присоединения (III) - ион, в котором атом углерода находится в sр3 -гибридном состоянии - тетраэдр, на кислороде - целый отрицательный заряд. Именно способность кислорода нести отрицательный заряд обусловливает реакционную способность карбонильных соединений по отношению к нуклеофилам. Стабилизация полученного иона происходит за счет присоединения протона воды или кислоты (IV). Реакционная способность карбонильных соединений определяется пространственными и электронными факторами. Поскольку в переходном состоянии углерод карбонила начинает принимать тетраэдрическую конфигурацию, и атомы, связанные с ним, несколько сближаются, то чем больше группы R1 и R2, тем сильнее они препятствуют такому сближению. При увеличении объема заместителей, расположенных у атома углерода карбонила, реакционная способность уменьшается.
В том же направлении действуют и электронные факторы. Алкильные группы проявляют электронодонорный индукционный эффект, дестабилизируют переходное состояние, увеличивая отрицательный заряд на атоме углерода, который подвергается атаке нуклеофила. Присоединение цианид-иона. Цианистый водород присоединяется ко многим альдегидам и кетонам, образуя циангидрины.
Реакцию проводят, добавляя минеральную кислоту к смеси карбонильного соединения и цианистого натрия, количество добавляемой кислоты должно быть недостаточным для связывания всех цианид-ионов.
Эти реакции имеют практическое применение для получения a-оксикислот, цианалкенов и непредельных кислот.
Присоединение бисульфита. Бисульфит натрия присоединяется к большинству альдегидов и метилкетонов.
Эту реакцию используют для очистки карбонильных соединений: полученный кристаллический продукт отделяют от некарбонильных примесей и добавлением кислоты или основания регенерируют карбонильное соединение.
Присоединение реактива Гриньяра. Реактивы Гриньяра присоединяются к альдегидам и кетонам быстро и необратимо.
Органический остаток, переносимый с парой электронов на углерод карбонильной группы, является сильным нуклеофилом. Другая молекула Присоединение ацетиленидов. Альдегиды и кетоны реагируют с ацетиленидом натрия, образуя алкоксиды натрия, гидролиз которых приводит к образованию спиртов, содержащих тройную связь.
5.2.2. Нуклеофильное присоединение - отщепление G–NH2 и спиртов C альдегидами и кетонами взаимодействуют соединения, родственныеаммиаку
Примеры нуклеофильных реагентов и продуктов взаимодействия приведены ниже.
Поскольку нуклеофил слабый (частица, не имеющая заряда), его присоединение катализируется кислотой. Предварительное протонирование карбонильного соединения делает его более реакционноспособным: на карбонильном углероде увеличивается положительный заряд (I), что позволяет кислороду приобрести пару электронов в результате нуклеофильной атаки, не получая при этом отрицательного заряда (II).
Продукты присоединения (IV) содержат группу с двойной связью Следует учесть, что производные аммиака
Кислотность среды, при которой присоединение будет протекать легче всего, определяется основностью реагента и реакционной способностью карбонильного соединения: раствор должен быть настолько слабокислым, чтобы значительное количество реагента оставалось не протонированным, и настолько сильнокислым, чтобы сделать достаточно реакционноспособным карбонильное соединение. Взаимодействие с гидроксиламином. Перегруппировка Бекмана. Продуктом взаимодействия альдегида или кетона с гидроксиламином является оксим. Скорость образования оксима максимальна при рН ~ 4.
Ранее оксимы применяли главным образом для идентификации альдегидов и кетонов. Однако они представляют интерес и для органического синтеза. Например, восстановлением оксимов могут быть получены первичные амины.
Оксимы при действии на них кислот превращаются в замещенные амиды кислот (перегруппировка Бекмана).
Сначала происходит протонирование оксима (I) и отщепление воды. Синхронно с отщеплением воды к атому азота из анти-положения мигрирует радикал R1. Карбокатион (II) захватывает молекулу воды с образованием оксоний-иона (III). Промежуточное соединение с гидроксилом у углерода при двойной связи (IV) перегруппировывается в амид (V). Бекмановская перегруппировка имеет промышленное значение при получении капролактама, используемого для получения высокомолекулярного поликапроамида – капрона (см. п. 10.2).
Взаимодействие со спиртами, образование ацеталей. Альдегид в безводном спирте, содержащем небольшое количество безводной кислоты, обычно хлористого водорода, превращается в ацеталь.
Воду удаляют по мере ее образования в виде азеотропа с бензолом и этиловым спиртом (Ткип. = 64,9 оС). Присоединение одной молекулы спирта приводит к образованию полуацеталя.
Полуацеталь представляет собой спирт и простой эфир одновременно, в присутствии кислот полуацеталь как спирт реагирует со второй молекулой спирта.
Ацетали – простые эфиры и как простые эфиры устойчивы по отношению к основаниям, но в отличие от них расщепляются кислотами значительно легче. Это объясняется тем, что на лимитирующей стадии обеих реакций – образование и расщепление ацеталей – образуется устойчивый карбониевый ион. Первичные ароматические амины взаимодействуют с ароматическими альдегидами с образованием оснований Шиффа.
Эти реакции не требуют катализатора. Реакция ароматических альдегидов с ароматическими аминами используют для защиты аминогруппы, так как полученные соединения легко гидролизуются в кислой среде с образованием исходных альдегида и амина. Шиффовы основания, образовавшиеся при взаимодействии первичных ароматических аминов с алифатическими альдегидами, неустойчивы и легко полимеризуются.
|
||||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 354; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.156.84 (0.009 с.) |








 действует как кислота Льюиса, облегчает присоединение нуклеофила СН3y.
действует как кислота Льюиса, облегчает присоединение нуклеофила СН3y.
 и спирты
и спирты  в этом случае реакция протекает как нуклеофильное присоединение с последующим отщеплением воды.
в этом случае реакция протекает как нуклеофильное присоединение с последующим отщеплением воды.





 , образующуюся в результате элиминирования молекулы воды из первоначального аддукта (II).
, образующуюся в результате элиминирования молекулы воды из первоначального аддукта (II). и спирты
и спирты  являются основаниями и взаимодействуют с кислотами, теряя приэтом способность реагировать как нуклеофилы.
являются основаниями и взаимодействуют с кислотами, теряя приэтом способность реагировать как нуклеофилы.