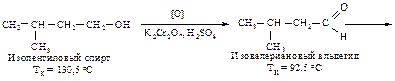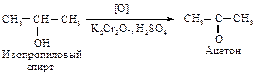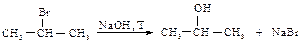Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реакция с участием связи R–OHСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Электроотрицательный кислород, оттягивая общую пару электронов связи Образование алкилгалогенидов. Спирты легко реагируют с галогеноводородами (HCl, HBr, HI). Реакционная способность падает в ряду НI > HBr > HCl.
Сухой газообразный галогеноводород пропускают в спирт или спирт нагревают с концентрированным раствором галогеноводорода. Реакция катализируется кислотами. Спирт, присоединяя протон, превращается в ион алкилоксония, который гораздо легче отщепляет нейтральную молекулу воды (“хорошая” уходящая группа), чем спирт – ион ОНy (“плохая” уходящая группа).
Метиловый и первичные спирты реагируют по механизму SN2.
Механизм: сначала происходит протонирование спирта
Вторичные и третичные спирты взаимодействуют с галогеноводородами по механизму SN1.
Механизм: 1 стадия, медленная: 2 стадия, быстрая: Поскольку реакции замещения у вторичных и третичных спиртов протекают через стадию образования карбониевого иона, возможна перегруппировка.
Механизм перегруппировки:
Реакционная способность спиртов по отношению к галогенводородам изменяется следующим образом: Бензиловый, аллиловый > третичный > вторичный > первичный < метанол
SN1 SN2
Реакция с галогенидами фосфора PCl5, PCl3, PBr3, PI3, тионилхлоридом SOCl2. Для получения алкилгалогенидов используют реакции спиртов с галогенидами фосфора и тионилхлоридом, они не сопровождаются перегруппировками.
Механизм реакции спирта с тионилхлоридом. Взаимодействие одного моля спирта с одним молем тионилхлорида приводит к нестойкому алкилхлорсульфиту.
В присутствии основания, обычно пиридина, происходит инверсия путем атаки хлорид-иона на хлорсульфит.
Однако при проведении синтеза в эфире в отсутствии основания создаются условия для сохранения конфигурации. Частица yОSOCl вытесняется из хлорсульфита и при этом создается тесная ионная пара, в которой атом хлора с фронта (со стороны уходящей группы) атакует углеродный атом.
Такой тип реакций называют внутримолекулярным (интрамолекулярным) замещением и обозначают символом SNi. Образование простых эфиров – межмолекулярная дегидратация. Межмолекулярная дегидратация спиртов служит примером нуклеофильного замещения, в котором субстратом является протонированная молекула спирта, а другая молекула ROH служит нуклеофилом. Первичные спирты реагируют по механизму SN2
Механизм: Протонирование спирта: Протонированный спирт подвергается атаке нуклеофилом
Применение этой реакции ограничено получением симметричных эфиров, т.к. при использовании различных спиртов получается смесь трех эфиров. Важным методом получения простых эфиров является реакция алкоксидов с алкилгалогенидами (синтез Вильямсона) или алкилсульфатами ROSO2OR.
Бόльшая нуклеофильность алкоксидиона RОy по сравнению со спиртом ROH означает бόльшую склонность к тому, чтобы выступать в качестве основания в реакции элиминирования. Поэтому при получении смешанных эфиров ROR1 следует учитывать возможность протекания конкурирующих реакций: нуклеофильного замещения и элиминирования. Например, для получения метилизопропилового эфира следует использовать йодистый метил и изопропилоксид натрия (пример 1), а не изопропилиодид и метоксид натрия (пример 2). Пример 1:
Пример 2:
Вторичные и третичные спирты не подвергаются межмолекулярной дегидратации, а реагируют с образованием продуктов внутримолекулярной дегидратации - алкенов.
Образование алкенов – внутримолекулярная дегидратация. Под влиянием электроотрицательного кислорода на связанном с кислородом атоме углерода появляется положительный заряд, это вызывает поляризацию связи углерод-углерод и далее связи
Спирт превращается в алкен при температуре ~ 200 оС в присутствии серной или фосфорной кислоты, либо при пропускании паров спирта над окисью алюминия (Al2O3 - кислота Льюиса) при температуре 300-350 оС. Механизм дегидратации Е1: Первая стадия, медленная – диссоциация протонированного спирта с образованием карбониевого иона.
Вторая стадия, быстрая: карбокатион теряет протон и образует алкен.
В отличие от галогеналканов, которые подвергаются элиминированию в основном по механизму Е2, спирты реагируют только по механизму Е1. Элиминирование Е2 требует присутствия сильного основания для отщепления протона, но кислая среда, необходимая для протонирования спирта, и сильное основание не совместимы. Направление элиминирования. Элиминирование спиртов происходит с образованием более устойчивого, т.е. более алкилированного алкена (правило Зайцева).
Перегруппировка. Поскольку реакция Е1 протекает через стадию образования карбокатиона, она может сопровождаться перегруппировкой:
Окисление, дегидрирование Первичные спирты можно окислить до альдегидов действием К2Сr2О7 + H2SO4, если одновременно с окислением вести отгонку легко окисляющихся альдегидов, кипящих при более низкой температуре, чем исходные спирты.
При нагревании первичных спиртов с водным раствором перманганата калия окисление идет до карбоновых кислот; выделить промежуточный продукт окисления – альдегид – не удается. Вторичные спирты окисляются до кетонов действием перманганата калия или хромовой кислотой.
Дальнейшее окисление кетона возможно только в жестких условиях, т.к. при этом происходит разрыв углерод-углеродной связи. Третичные спирты в присутствии кислот превращаются в алкены, которые далее легко окисляются. В щелочной и нейтральной средах третичные спирты не окисляются. Превращение первичных спиртов в альдегиды, вторичных – в кетоны можно осуществлять, нагревая пары спирта до температуры 200-300 оС над медным катализатором – реакция дегидрирования.
Способы получения Гидратация алкенов Присоединение воды к алкенам происходит в присутствии кислых катализаторов (серная, фосфорная кислоты, оксид алюминия или другой носитель, обработанный кислотами). Реакция идет по механизму электрофильного присоединения АЕ.
Поскольку реакция электрофильного присоединения протекает через стадию образования карбокатиона, возможна перегруппировка с образованием наиболее устойчивого карбокатиона. Гидролиз галогеналканов Гидролиз галогеналканов проводят при нагревании с водным раствором щелочей. Реакция протекает по механизму SN1 или SN2 в зависимости от строения галогеналкана.
Если реакция протекает по механизму SN1, возможна перегруппировка с образованием наиболее устойчивого карбокатиона.
|
||||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 667; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.98.244 (0.009 с.) |

 , создает частичный положительный заряд науглероде иэтот атом углерода может подвергаться атаке нуклеофила:
, создает частичный положительный заряд науглероде иэтот атом углерода может подвергаться атаке нуклеофила: 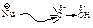 .
.


 , а затем атака нуклеофилом Bryатома углеродас образованием переходного состояния и последующее отщепление молекулы воды:
, а затем атака нуклеофилом Bryатома углеродас образованием переходного состояния и последующее отщепление молекулы воды:








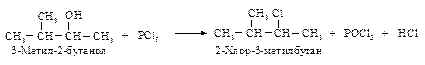











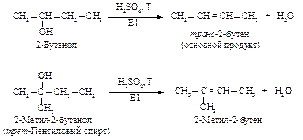
 .В определенных условиях водород при Сβ способен отщепляться в виде протона, происходит реакция элиминирования
.В определенных условиях водород при Сβ способен отщепляться в виде протона, происходит реакция элиминирования