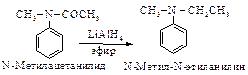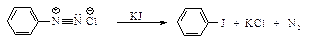Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реакции аминов с азотистой кислотойСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Первичные амины ароматического ряда реагируют с азотистой кислотой с образованием солей диазония.
Первичные алифатические амины также дают соли диазония, но они очень неустойчивы и легко разлагаются. Вторичные амины образуют нитрозоамины.
Третичные ароматические амины взаимодействуют с азотистой кислотой с образованием соединений, содержащих нитрозогруппу в ароматическом кольце.
Поскольку Способы получения 12.3.1. Восстановление азотсодержащих соединений: Нитросоединений, нитрилов, амидов Азотсодержащие соединения можно восстановить каталитическим гидрированием, с помощью металлов в присутствии минеральной кислоты, литийалюминийгидридом.
Взаимодействие галогенпроизводных с аммиаком или аминами
Как правило, в реакции галогеналкана с аммиаком образуется смесь первичных, вторичных и третичных аминов, что является серьезным недостатком метода. Более того, при применении избытка галогеналкана третичный амин подвергается дальнейшему алкилированию с образованием четвертичной аммониевой соли (переалкилирование амина).
На этой стадии реакция заканчивается. Реакция переалкилирования может быть подавлена применением значительного избытка аммиака или амина, который подвергается алкилированию. Взаимодействие спиртов с аммиаком или аминами В промышленности амины получают аминолизом спиртов в присутствии катализаторов дегидратации (Al2O3, SiO2, ThO2 и т.п.) при 300-500 оС. При этом также образуется смесь первичных, вторичных и третичных аминов.
Этот метод также применяют для получения N-алкил- и N,N-диалкиланилинов. Обычно в таких случаях алкилирование спиртами ведут в присутствии кислот.
Восстановительное аминирование Альдегиды и кетоны при обработке аммиаком или амином и водородом в присутствии катализатора превращаются в амины.
Расщепление амидов по Гофману Реакцией амидов со щелочным раствором галогена (хлора, брома или иода) получают первичные амины. В ходе реакции углеродная цепь укорачивается на один атом углерода.
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ Соединения, в которых группа –N2– связана с углеводородным радикалом и неуглеводородным радикалом Х, относятся к диазосоединениям. Ar–N2X, где X - Br–, Cl–, NO3–, HSO4– - cоли диазония; Ar–N2OH - диазогидрат. Диазотирование проводят следующим образом: амин растворяют или суспензируют в минеральной кислоте. Смесь охлаждают до температуры от 0 до 10 оС, затем прибавляют водный раствор нитрита натрия с такой скоростью, чтобы температура была ~5 оС.
Механизм:
При подщелачивании равновесие смещается в сторону образования диазогидрата. Свойства солей диазония Реакции солей диазония с выделением азота. Соли диазония ценны в синтезе не только потому, что они способны давать большое число соединений, но и потому, что их можно получать почти из всех первичных ароматических аминов, которые получают восстановлением нитросоединений, а они в свою очередь могут быть получены из углеводородов прямым нитрованием.
Реакции замещения на галоген. Замещение диазогруппы на хлор и бром осуществляют, смешивая свежеприготовленный раствор соли диазония с хлоридом или бромидом одновалентной меди в присутствии соответствующей галогеноводородной кислоты. Эти реакции с использованием СuÅ называются реакциями Зандмейера. Аналогична ей реакция Гаттермана с той лишь разницей, что в этом случае вместо галогенида меди (I) берут металлическую медь и галогеноводородную кислоту.
Замещение диазогруппы на Iy не требует применения меди СuÅ или порошка меди, достаточно подействовать на соль диазония иодидом калия.
Замещение на -CN. Реакция Зандмейера применяется также для синтеза ароматических нитрилов, которые гидролизом могут быть превращены в кислоты.
Таким образом, нитросоединения можно превращать в карбоновые кислоты. Замещение на -ОН
Эта реакция медленно протекает даже в ледяном растворе, и это является причиной, по которой соли диазония надо использовать сразу после их приготовления. При повышенной температуре эта реакция становится главной. Замещение на –Н. Соль диазония, оставленная стоять в присутствии восстановителя (чаще всего фосфорноватистая кислота Н3РО2), превращается в углеводород.
С помощью этой реакции можно удалять из кольца группу - NH2. Замещение на -NО2. На соль диазония действуют нитритом натрия и солью одновалентной меди Cu+ (реакция Зандмейера).
|
||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 1849; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.007 с.) |





 - слабый электрофильный реагент по сравнению сдругими электрофилами, нитрозирование происходит только в том случае, если в кольце имеется сильная электронодонорная группа. Реакция аминов с азотистой кислотой - это электрофильная атака
- слабый электрофильный реагент по сравнению сдругими электрофилами, нитрозирование происходит только в том случае, если в кольце имеется сильная электронодонорная группа. Реакция аминов с азотистой кислотой - это электрофильная атака