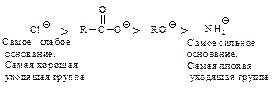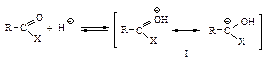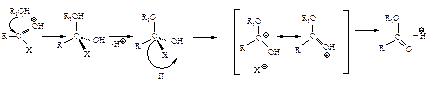Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Замещение в ароматическом ядреСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Электроноакцепторная карбоксильная группа, проявляющая эффекты -I, -M, дезактивирует ароматическое кольцо в реакциях электрофильного замещения.
Способы получения Окисление первичных спиртов При нагревании первичных спиртов с водным раствором перманганата калия получают карбоновые кислоты
Окисление алкилбензолов Это один из наиболее часто применяемых способов получения ароматических кислот. Окисление проводят либо при кипячении углеводорода с перманганатом калия, либо кислородом воздуха в присутствии катализаторов окисления.
Гидролиз нитрилов Реакцию гидролиза производных карбоновых кислот часто применяют в лабораторной практике. Нитрилы гидролизуют при нагревании (как правило, при кипячении) с водными растворами минеральных кислот (реже – щелочей).
Гидролиз тригалогенпроизводных Гидролиз тригалогенпроизводных для получения карбоновых кислот применяют реже. При этом используют те же условия, что и при гидролизе нитрилов и сложных эфиров.
Карбоксилирование реактива Гриньяра Карбоксилирование реактива Гриньяра служит одним из универсальных способов получения карбоновых кислот.
Этот метод имеет, однако, ограничение. Алкил- и арилгалогениды, применяемые в реакциях, не должны содержать заместители (–ОН, –NH2, –SH, –C=О), которые активно реагируют с реактивам Гриньяра. Функциональные производные карбоновых кислот Функциональными производными карбоновых кислот
Ацильная группа является общим элементом функциональных производных карбоновых кислот. К производным карбоновых кислот относятся и нитрилы RCºN, так как при гидролизе они также превращаются в кислоты. Химические свойства Реакционная способность Ацильные соединения, т.е. карбоновые кислоты и их функциональные производные, вступают в реакции нуклеофильного замещения групп Х: –ОН, –Сl, –OCOR, –OR, NH2.
Первая стадия нуклеофильной атаки по карбонильному углероду одинакова для альдегидов, кетонов и ацильных соединений – образование продукта присоединения по двойной связи. Как и в случае альдегидов и кетонов, пространственные и электронные факторы делают карбонильную группу доступной для атаки нуклеофильным реагентом: а) атака нуклеофила по углероду плоской группы
В случае ацильных соединений стабилизация промежуточного аниона происходит путем отщепления групп, которые являются слабыми основаниями Сly, RCOOy или сравнительно сильными основаниями R1Oy, NH2y. У альдегидов и кетонов во второй стадии реакции не происходит отщепления ионов Нy или Ry, так как они являются самыми сильными основаниями и, следовательно, очень “плохими” уходящими группами, поэтому вместо отщепления Нy или Ry происходит присоединение НÅ. Таким образом, нуклеофильное замещение в ацильных производных происходит в две стадии: 1) нуклеофильное присоединение по двойной связи
По легкости протекания второй стадии ацильные производные располагаются в следующий ряд:
Как и в реакциях альдегидов и кетонов, в случае слабого нуклеофила (Н2О, RОН) реакция катализируется кислотой: во-первых, протон НÅ делает карбонильную группу более доступной для нуклеофильной атаки (I), во-вторых, в этом случае образуется устойчивый незаряженный промежуточный продукт (II)
Хлорангидриды и ангидриды очень реакционноспособные соединения; даже со слабыми нуклеофилами они реагируют без катализатора. Например, хлористый ацетил бурно реагирует с водой, хлорангидриды ароматических кислот менее реакционноспособны.
|
||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 523; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.225.72.181 (0.006 с.) |

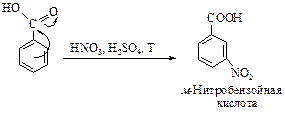
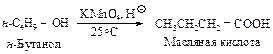
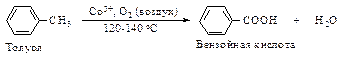

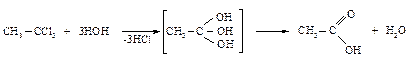
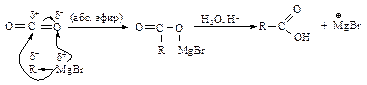
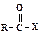 являются соединения, образующиеся при замещении гидроксильной группы –ОН на другую группу Х и вновь превращающиеся при гидролизе в карбоновые кислоты.
являются соединения, образующиеся при замещении гидроксильной группы –ОН на другую группу Х и вновь превращающиеся при гидролизе в карбоновые кислоты.
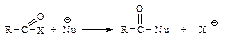
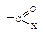 не затруднена, тригональный углерод относительно беспрепятственно превращается в тетраэдрический промежуточный продукт (III); б) электроотрицательный кислород легко приобретает и несет на себе отрицательный заряд, возникающий в промежуточном соединении; дальнейшее превращение ионов (I) и (III) различно: промежуточный продукт, образующийся из альдегидов и кетонов (I), присоединяя протон, дает продукт присоединения (II), а промежуточный продукт, образующийся из ацильного производного (III), отщепляет группу Х, и в результате образуется продукт замещения (IV).
не затруднена, тригональный углерод относительно беспрепятственно превращается в тетраэдрический промежуточный продукт (III); б) электроотрицательный кислород легко приобретает и несет на себе отрицательный заряд, возникающий в промежуточном соединении; дальнейшее превращение ионов (I) и (III) различно: промежуточный продукт, образующийся из альдегидов и кетонов (I), присоединяя протон, дает продукт присоединения (II), а промежуточный продукт, образующийся из ацильного производного (III), отщепляет группу Х, и в результате образуется продукт замещения (IV).
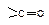 с образованием промежуточного тетраэдрического продукта; 2) стабилизация последнего путем отщепления группы Хy (уходящая группа). Способность быть “хорошей” уходящей группой соответственно уменьшается в ряду
с образованием промежуточного тетраэдрического продукта; 2) стабилизация последнего путем отщепления группы Хy (уходящая группа). Способность быть “хорошей” уходящей группой соответственно уменьшается в ряду