
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Галогенирование кетонов - реакции с участием карбанионовСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Галогенирование кетонов происходит путем замещения исключительно a-водородного атома.
Реакция протекает следующим образом: 1 стадия – медленная: основание отрывает протон от ацетона, образуя карбанион (I).
2 стадия – быстрая: анион (I) взаимодействует с молекулой брома, поляризованной под влиянием отрицательного заряда карбаниона.
Приведенный механизм подтверждают данные по изучению кинетики: скорость реакции зависит от концентрации ацетона и основания, но не зависит от концентрации брома; скорость галогенирования не зависит также от природы галогена, будь то хлор, бром или иод. Последующее замещение атомов водорода протекает быстрее.
Трибромацетон легко расщепляется основанием с образованием бромоформа (галоформная реакция).
Взаимодействие альдегидов и кетонов с пентахлоридом фосфора Альдегиды и кетоны при взаимодействии с РCl5 обменивают атом кислорода на два атома хлора, что используется для получения геминальных дихлоралканов (оба атома хлора присоединены к одному и тому же атому углерода).
Восстановление В результате каталитического гидрирования альдегиды восстанавливаются в первичные спирты, кетоны – во вторичные.
Литийалюминийгидрид* LiAlН4 – удобный, но дорогой восстанавливающий агент, используют для синтеза спиртов, которые менее доступны, чем карбонильные соединения. Эта реакция представляет собой нуклеофильное присоединение: нуклеофилом является водород, переносимый вместе с парой электронов
Образовавшийся таким образом комплексный алкоксид алюминия подвергается гидролитическому расщеплению.
Литийалюминийгидрид обычно восстанавливает карбонильные группы, не затрагивая двойные углерод-углеродные связи.
Альдегиды и кетоны можно восстанавливать в углеводороды при действии амальгамированного цинка и концентрированной соляной кислоты (восстановление по Клемменсену).
Окисление Альдегиды легко окисляются даже при действии таких слабых окислителей, как ион серебра.
Эта реакция используется главным образом для идентификации альдегидов. Как способ получения она представляет интерес только в тех случаях, когда альдегиды более доступны, чем кислоты.
Окисление кетонов требует разрыва углерод-углеродной связи и поэтому происходит лишь в довольно жестких условиях (исключение составляет галоформная реакция). Реакция редко представляет интерес для синтеза; кетоны расщепляются с обеих сторон карбонильной группы, приводя к образованию смеси продуктов.
Важное значение имеет окисление циклических кетонов, которое приводит к дикарбоновым кислотам.
Способы получения Окисление и дегидрирование первичных и вторичных спиртов Окислением первичных спиртов получают альдегиды, а окислением вторичных спиртов – кетоны.
В качестве окислителей чаще всего используют K2Cr2O7 + H2SO4. Окисление вторичных спиртов не сопряжено с осложнениями. Окисление первичных спиртов требует осторожности, поскольку образующийся на первой стадии альдегид способен к быстрому окислению до карбоновой кислоты. В этом случае одновременно с окислением ведут отгонку легкокипящих альдегидов. 5.3.2. Гидратация алкинов (реакция Кучерова) Гидратация ацетилена – один из ранних способов получения ацетальдегида в промышленности.
Гидратация дает хорошие результаты также в случае алкинов с концевой тройной связью и симметричных алкинов. Ацилирование по Фриделю-Крафтсу Для получения ароматических и жирноароматических кетонов чаще всего применяют реакцию Фриделя-Крафтса.
Гидролиз дигалогенметиларенов Реакция гидролиза протекает гладко, однако имеет ограниченное применение из-за малой доступности дигалогенметиларенов и представляет препаративный интерес лишь при работе с дихлорметиларенами.
|
|||||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 1114; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.146.107.223 (0.012 с.) |







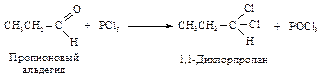



 от металла на карбонильный углерод. Реакция ведется в эфире.
от металла на карбонильный углерод. Реакция ведется в эфире.














