
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химические свойства альдегидов и кетоновСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Оксосоединения - активны в химическом отношении и вступают в многочисленные реакции. Их химическая активность обусловлена присутствием в их молекулах одной из наиболее активных функциональных групп − карбонильной. Двойная связь между углеродом и кислородом состоит из одной σ- и одной π-связи. Эта двойная связь сильно поляризована. Причина этого в разности электроотрицательностей атомов кислорода и углерода (ЭО > ЭС). Такая поляризация двойной связи и является причиной высокой реакционной способности альдегидов и кетонов. При этом кислород оксогруппы проявляет нуклеофильный характер, а углерод – электрофильный
Альдегиды и кетоны вступают в реакции присоединения, замещения, конденсации, полимеризации, окисления. 1. 4.1. Реакции присоединения При взаимодействии с полярными реагентами π-связь карбонильной группы разрывается. В результате этого происходит присоединение атомов или групп атомов атакующего агента по месту разрыва связи.
1.4.1.1. Гидрирование В этом случае в качестве восстановителя часто используют литийалюминийгидрид LiAlH4 (его действие избирательно). Восстанавливая карбонильную группу, он не затрагивает углерод-углеродную двойную связь в непредельных альдегидах и кетонах. В этом случае альдегиды переходят в первичные спирты, а кетоны – во вторичные:
1.4.1.2. Взаимодействие с синильной кислотой
Процесс протекает в присутствии основания. Полученные соединения называются циангидринами или гидроксинитрилами и используются при получении гидроксикислот, аминокислот и др.
циангидрин
1.4.1.3. Взаимодействие с гидросильфитом натрия
Кетоны вступают в эту реакцию в том случае, если содержат хотя бы одну метильную группу:
В результате подобных процессов образуются гидросульфитные соединения, легко разлагающиеся при нагревании с разбавленными кислотами с выделением в чистом виде альдегидов или кетонов.
1.4.1.4. Взаимодействие с магний органическими соединениями – реактивами Гриньяра
При разложении водой получающихся органических соединений образуются соответственно первичные (в случае метаналя), вторичные (гомологи метаналя) или третичные (в случае кетонов) спирты.
1.4.1.5. Взаимодействие с водой
гидрат формальдегида
Метаналь легко присоединяет воду, образуя гидрат. Однако гидраты других альдегидов и кетонов в свободном виде выделить не удается. Однако в присутствии сильных электроноакцепторных групп в ά-положении альдегиды способны образовывать устойчивые гидраты, например хлоральдегид:
хлораль хлоральдегид
1.4.1.6. Присоединение спиртов приводит к образованию полуацеталей:
полуацеталь
Полуацетали − устойчивые соединения. В избытке спирта можно получить полные простые эфиры гидратной формы альдегида – ацетали. Кетоны кеталей не образуют.
ацеталь
Реакции замещения Реакции замещения идут с замещением карбонильного кислорода или атомов водорода в углеводородном радикале.
1.4.2.1. Замещение карбонильного кислорода хлором: Этот процесс протекает при взаимодействии альдегидов или кетонов с пятихлористым фосфором.
альдегид дигалогенпроизводное
кетон дигалогенпроизводное.
1.4.2.2. Замещение атомов водорода в радикале В этом случае нужно помнить, что легче всего процесс замещения водорода протекает у третичного углерода, затем у вторичного и в последнюю очередь − у первичного.
2-метилпропаналь 2-метил-2-хлорпропаналь
Реакции конденсации Под влиянием карбонильной группы водородные атомы соседнего с ней метильного радикала в слабоосновной среде приобретают некоторую подвижность. При этом водород, отрываясь от метильного радикала в виде протона, переходит к карбонильному кислороду, а анион – к карбонильному углероду. В результате образуется гидроксиальдегид – альдоль (межмолекулярная дегидратация).
бутанол-3-аль (альдоль)
При нагревании альдоля происходит отщепление воды (дегидратация) с образованием непредельного соединения (внутримолекулярная дегидратация).
бутен-2-аль (кротоновый альдегид)
Последний процесс отщепления молекулы воды протекает в соответствии с правилом Зайцева – водородный атом отщепляется от наименее гидрогенизированного углерода.
Реакции окисления В процессе полного окисления, протекающего при избытке кислорода, и альдегидов и кетонов образуются диоксид углерода СО2 и вода. В результате неполного окисления и альдегидов, и кетонов получаются карбоновые кислоты.
При окислении альдегидов аммиачным раствором оксида серебра происходит выделение металлического серебра, которое тонким слоем покрывает внутреннюю обезжиренную поверхность стеклянной пробирки, где проводится реакция. Эта «реакция серебряного зеркала» является качественной и используется при распознавании альдегидов. Кетоны окисляются труднее. При действии на кетоны сильных окислителей [О] разрывается углеродная цепь (происходит разрыв углерод-углеродной связи справа и слева от кетогруппы) и получается смесь различных карбоновых кислот. При окислении симметричных кетонов получается смесь из двух карбоновых кисло:
пропанон этановая кислота метановая кислота
При окислении несимметричных кетонов получается смесь из большего количества карбоновых кислот:
СН3СН2—СО— СН2СН2СН2СН3 + [О] → СН3 —СООН +
СН3СН2 СН2СН2—СООН + СН3СН2СН2—СООН + СН3 СН2—СООН
Например, при неполном окислении гептанона-3 получаются этановая, пентановая, бутановая и пропановая карбоновые кислоты. По продуктам, полученным в процессе окисления, можно судить о строении кетонов. Реакции полимеризации Эти реакции характерны только для альдегидов. При воздействии минеральных кислот альдегиды полимеризуются с образованием циклических продуктов:
или линейных полимерных соединений:
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ 2.1. Окисление формальдегида аммиачным раствором окиси серебра (восстанавливающая способность формальдегида) Альдегиды легко окисляются и могут служить хорошими восстановителями. Эта реакция протекает особенно легко в присутствии едкой щелочи. Хорошим р е а к т и в о м н а а л ь д е г и д ы служит бесцветный аммиачный раствор окиси серебра. Этот реактив готовят непосредственно перед проведением опыта. Для проведения эксперимента нужны две чистые (!) и сухие пробирки. В каждую пробирку вносим по 1 мл 0,2 н. раствoра AgNO3. В первую пробирку добавляем 1 мл 0,2 н. раствор NaOH. К полученному бурому осадку, помешивая его тонкой стеклянной палочкой, добавляем по каплям 2 н. раствор NH4OH до растворения осадка. Во вторую пробирку, не добавляя щелочи, прибавить сразу 1 мл 2 н. раствора NH4OH. Полученный бурый осадок гидрата окиси серебра растворяем, добавляя в пробирку по каплям избыток раствора аммиака. К прозрачным растворам в обеих пробирках добавить 0,5-1 мл 1 %-ного формалина (для получения нужной концентрации формальдегида надо 40 %-ный формалин разбавить дистиллированной водой в 40 раз). В первой пробирке практически мгновенно (при комнатной температуре) выпадает черный осадок – восстановленное серебро. Во второй пробирке процесс протекает очень медленно (при комнатной температуре). Для ускорения процесса пробирку необходимо осторожно прогреть – на расстоянии 15-20 см от пламени спиртовки. При этом серебро может выделиться на внутренней поверхности стекла в виде блестящего зеркального налета при условии, что его поверхность не была загрязнена маслами и др. Поэтому эта реакция называется «реакцией серебряного зеркала». Положительной реакций считается и просто почернение или даже побурение бесцветного раствора. Реакция протекает по схеме:
метаналь метановая кислота
2.2. Окисление формальдегида гидратом окиси меди в щелочном растворе (восстанавливающая способность формальдегида) Поместите в пробирку 5 капель2 н. раствора NaOH, разбавте его 6 каплями дистиллированной воды и добавьте 2 капли 0,2 н. раствора CuSO4. К выпавшему осадку гидрата окиси меди прибавьте 1 каплю 40 %-ного формалина и хорошо перемешайте раствор. Нагрейте над пламенем спиртовки только верхнюю часть раствора так, чтобы нижняя часть пробирки осталась холодной (для контроля). Нагревать раствор только до кипения, кипятить раствор нет надобности. В нагретой части пробирки должен выделиться красный осадок металлической меди. Если внутренняя поверхность пробирки совершенно чистая, осадок отлагается на ней в виде блестящего металлического слоя − медного зеркала.
|
||||||||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 526; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.128.94.112 (0.009 с.) |

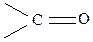 кетон
кетон
























