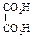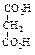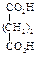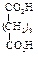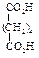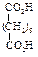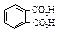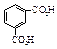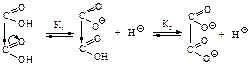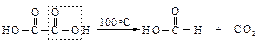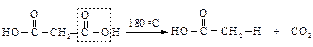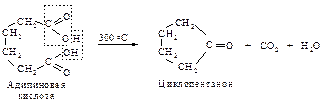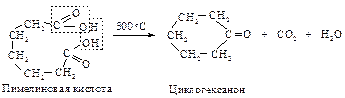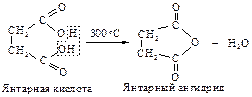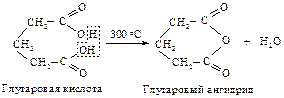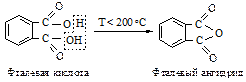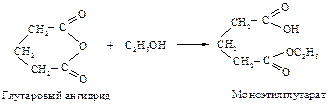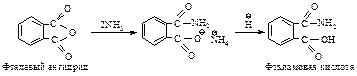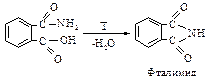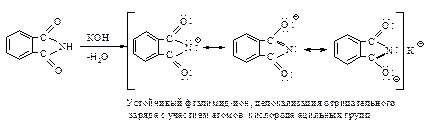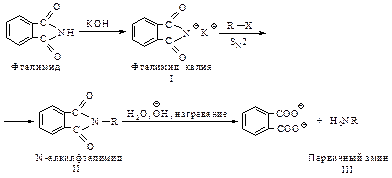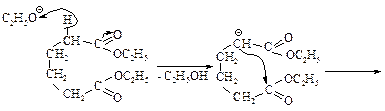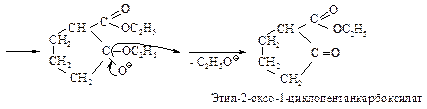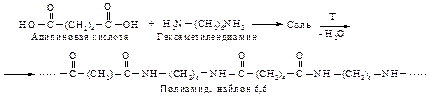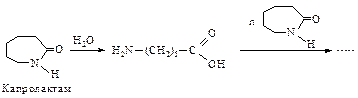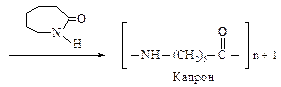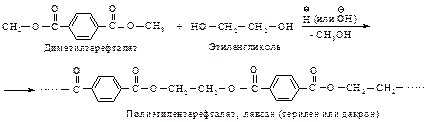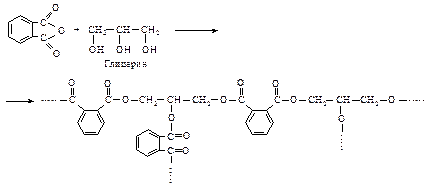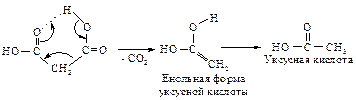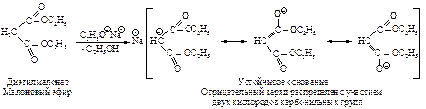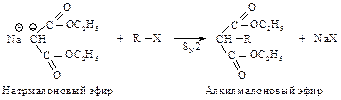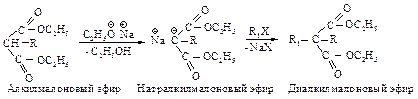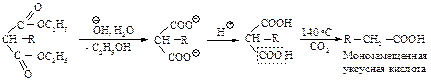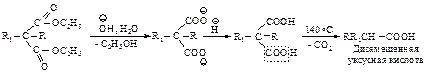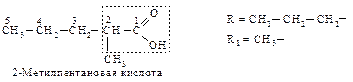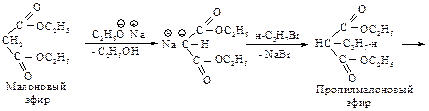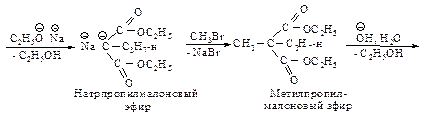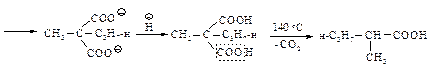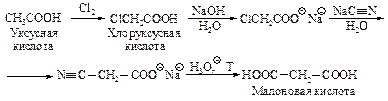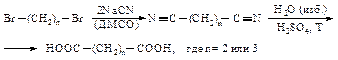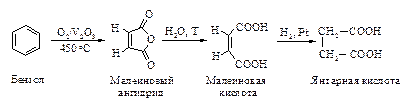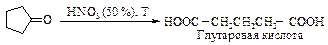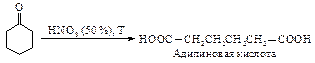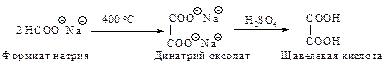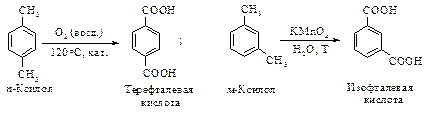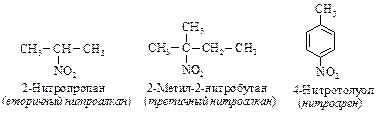Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
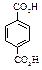
Физические свойства дикарбоновых кислотСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Влияние одной карбоксильной группы, проявляющей электроноакцепторный индукционный эффект, на другую в этом случае максимально. Сила кислот уменьшается с увеличением числа углеродных атомов между ними, т.к. влияние одной карбоксильной группы на другую ослабевает. Вторая константа диссоциации (К2) меньше вследствие того, что отрыв второго протона от карбоксилат-иона оказывается более трудным, чем отрыв первого протона от нейтральной молекулы. Поведение при нагревании Длина цепи, разделяющей карбоксильные группы, определяет характер превращений при нагревании. При нагревании щавелевой и малоновой кислот происходит их декарбоксилирование.
Если же при декарбоксилировании возможно образование устойчивых пяти- и шестичленных циклов, то они и образуются: адипиновая кислота циклизуется в циклопентанон, а пимелиновая – в циклогексанон.
Янтарная и глутаровая кислоты не образуют при нагревании напряженные циклические кетоны: циклопропанон и циклобутанон, а превращаются в пяти- и шестичленные циклические ангидриды.
Фталевая кислота ведет себя аналогичным образом.
Циклические ангидриды, как и ангидриды карбоновых кислот, вступают в реакции со спиртами, ароматическими углеводородами, с аммиаком или аминами.
Если это соединение, содержащее кислотную и амидную группы, нагреть, то отщепляется молекула воды и образуется имид, в котором две ацильные группы связаны с азотом.
Аналогичная реакция происходит и с янтарным ангидридом: последовательно получаются сукцинамовая кислота и сукцинимид. Наличие двух ацильных групп увеличивает кислотность имидов настолько, что они могут растворяться в холодном растворе щелочи.
Это свойство используется в синтезе первичных аминов поГабриелю. Фталимид превращают в калиевую соль (I), ее алкилирование дает N-алкилфталимид (II), который можно легко гидролизовать до соответствующего амина (III).
Эфиры некоторых дикарбоновых кислот вступают во внутримолекулярную конденсацию Кляйзена так же, как и эфиры монокарбоновых кислот, если при этом может образоваться ненапряженный пяти- или шестичленный цикл (конденсация Дикмана). При этом получается циклический b-кетоэфир.
Поликонденсация. При взаимодействии кислот, содержащих две карбоксильные группы, с аминами, в которых более одной аминогруппы, или со спиртами, имеющими в молекуле более одной группы -ОН, образуются полиамиды и полиэфиры.
Полиимидным волокном является также поли-e-капроамид, который получают полимеризацией с раскрытием цикла e-капролактама при температуре 250-260 оС. В качестве инициатора используют воду.
Полиэфиры широко используют в производстве синтетических волокон (полиэфирные волокна). Один из наиболее промышленно важных полиэфиров – лавсан – получают поликонденсацией диметилтерефталата и этиленгликоля.
Такие полимеры состоят из длинных линейных молекул, которые способны образовывать волокна. Полимеры наподобие глифталевых смол имеют сетчатую структуру с поперечными связями. Такие смолы используют в качестве защитных покрытий.
Синтезы при помощи малонового эфира. Эти синтезы основаны, во-первых, на легкости декарбоксилирования и, во-вторых, на высокой кислотности a-водородных атомов малонового эфира. 1. Термическое декарбоксилирование кислот происходит с большой легкостью в тех случаях, когда с a-углеродом связана сильная электроноакцепторная группа. НООС – СН2 – СООН - малоновая кислота СН3 – СО – СН2 – СООН - ацетоуксусная кислота О2N – CH2 – COOH - нитроуксусная кислота Механизм декарбоксилирования можно представить как циклический процесс отщепления, в котором важную роль играет образование водородной связи.
2. Высокая кислотность a-водородных атомов обусловлена устойчивостью сопряженного основания вследствие резонансной стабилизации за счет распределения отрицательного заряда на атомах кислорода карбонильных групп.
Реакция натрмалонового эфира с алкилгалогенидом приводит к замещенному малоновому эфиру – алкилмалоновому эфиру.
Эта реакция представляет собой нуклеофильное замещение в галогеналканах с наибольшим выходом в случае первичных галогеналканов, с меньшим – с использованием вторичных. Реакция не имеет практической ценности в случае третичных галогеналканов. Алкилмалоновый эфир содержит еще один водород, способный замещаться на натрий. Образующаяся соль также может реагировать с алкилгалогенидом, превращаясь в диалкилмалоновый эфир.
При нагревании выше температуры плавления алкил- и диалкилмалоновые эфиры так же, как и малоновая кислота, легко теряют диоксид углерода, превращаясь в замещенные уксусные кислоты.
При планировании синтеза карбоновой кислоты с помощью малонового эфира следует рассматривать ее как замещенную уксусную кислоту.
Следовательно, для получения 2-метилпентановой кислоты нужно последовательно провести следующие превращения.
Способы получения Общие методы получения дикарбоновых кислот аналогичны способам получения монокарбоновых кислот. Малоновую кислоту синтезируют из уксусной кислоты.
Янтарную и глутаровую кислоты можно получить через соответствующие динитрилы.
Янтарную кислоту получают также и по следующей схеме.
Глутаровая и адипиновая кислоты образуются окислением циклопентанона и циклогексанона соответственно. При этом в промышленности в качестве окислителя применяют разбавленную азотную кислоту.
Щавелевую кислоту получают при нагревании формиата натрия.
Окисление соответствующих ксилолов дает фталевые кислоты. Терефталевую кислоту получают жидкофазным окислением п- ксилола, а фталевую – парофазным окислением о- ксилола или нафталина с последующим гидролизом фталевого ангидрида.
НИТРОСОЕДИНЕНИЯ Нитросоединения R-NO2, Ar-NO2 – очень важный класс азотистых производных. Классификация нитросоединений производится в зависимости от углеродного фрагмента: нитроалканы, нитроциклоалканы и нитроарены, и от типа углеродного атома, связанного с группой –NO2: первичные, вторичныеи третичные. Название нитросоединения образуется от названия углеводорода с префиксом нитро-:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 492; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.179.30 (0.008 с.) |