Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Амины и аминокислоты. Общая характеристика. Методы получения.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Амины – азотсодержащие органические вещества, производные аммиака (NH3), в молекулах которых один или несколько атомов водорода замещены на углеводородный радикал (- R или – CnH2n+1) Функциональная группа: - NH2 аминогруппа
Номенклатура аминов 1. В большинстве случаев названия аминов образуют из названий углеводородных радикалов и суффикса амин.CH3-NH2 Метиламин CH3-CH2-NH2 Этиламин Различные радикалы перечисляются в алфавитном порядке. CH3-CH2-NH-CH3 Метилэтиламин При наличии одинаковых радикалов используют приставки ди и три. (CH3)2NH Диметиламин 2. Первичные амины часто называют как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на аминогруппы -NH2. В этом случае аминогруппа указывается в названии суффиксами амин (одна группа -NH2), диамин(две группы -NH2) и т.д. с добавлением цифр, отражающих положение этих групп в главной углеродной цепи. Например:CH3-CH2-CH2-NH2 пропанамин-1H2N-CH2-CH2-CH(NH2)-CH3 бутандиамин-1,3 6. Изомерия аминовСтруктурная изомерия - углеродного скелета, начиная с С4H9NH2: - изомерия аминогруппы, связанная с изменением степени замещенности атомов водорода при азоте, т.е. между типами аминов: Получение аминов. Из-за запаха низшие амины долгое время принимали за аммиак, пока в 1849 году французский химик Шарль Вюрц не выяснил, что в отличие от аммиака, они горят на воздухе с образованием углекислого газа. Он же синтезировал метиламин и этиламин. R-NO2 + 6[H] t,kat-Ni → R-NH2 + 2H2O R-NO2+3(NH4)2S t, Fe в кислой среде →R-NH2 +3S↓ +6NH3↑ + 2H2O Другие способы:1). Промышленный CH3Br + 2NH3 t, ↑p → CH3-NH2 + NH4Br 2). Лабораторный - Действие щелочей на соли алкиламмония [R-NH3]Г + NaOH t → R-NH2 + NaГ + H2O 3). Действием галогеналканов на первичные алифатические и ароматические аминыполучают вторичные и третичные амины, в том числе, смешанные. 8. Физические свойства аминов. При обычной температуре только низшие алифатические амины CH3NH2, (CH3)2NH и (CH3)3N – газы (с запахом аммиака), средние гомологи – жидкости (с резким рыбным запахом), высшие – твердые вещества без запаха. Ароматические амины – бесцветные высококипящие жидкости или твердые вещества.Амины способны к образованию водородных связей с водой: Поэтому низшие амины хорошо растворимы в воде. С увеличением числа и размеров углеводородных радикалов растворимость аминов в воде уменьшается, т.к. увеличиваются пространственные препятствия образованию водородных связей. Ароматические амины в воде практически не растворяются.Анилин (фениламин) С6H5NH2 – важнейший из ароматических аминов: Анилин представляет собой бесцветную маслянистую жидкость с характерным запахом (т. кип. 184 °С, т. пл. – 6 °С). На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит. Реакция горения (полного окисления) аминов на примере метиламина: 4СH3NH2 + 9O2 → 4CO2 + 10H2O + 2N2 Это соединения, содержащие в молекуле одновременно гр. –NН2и –ОН. Первый член гомологического ряда
Коламин входит в состав сложных липидов. Производное коламина – димедрол – обладает противоаллергическим и слабым снотворным действием. Коламин по гр. –NН2 проявляет свойства аминов и спиртов. Р-ции, протекающие по –ОН гр: с Ме, РС15, НС1, R–C1, R–COC1; р-ции окисления и дегидратации. 1. Взаимодействие с активными металлами. 2. Взаимодействие с РCl5 и НСl (реакции SN) 3. Взаимодействие с галогеналканами: 4. Взаимодействие с ангидридами кислот: 1. Взаимодействие с сильными кислотами приводит к образованию устойчивых солей. 2. Взаимодействие с водой. 3. Взаимодействие с ангидридами кислот. 4. В реакции алкилирования коламин образует метилированное производное по типу четвртичного аммониевого основания – холин – триметилоксиэтилгидроксид аммония:
21. Карбоновые кислоты и их производные. Общая характеристика. Карбоновыми кислотами называются соединения, содержащие карбоксильную группу
2-хлор-5-метилгептановая кислота CH3—CH=CH—COOH бутен-2-овая кислота Часто карбоксильную группу рассматривают как заместитель в молекуле углеводорода. При этом в названии употребляют словосочетание "карбоновая кислота" и в нумерацию атомов углерода цепи атом углерода карбоксильной группы не включают: СН3(СН2)7СН=СН(СН2)7СООН Гептадецен-8-карбоновая (олеиновая) кислота Названия дикарбоновых кислот производят от названия соответствующего углеводорода с добавлением суффикса "диовая" и слова "кислота". Например, этандиовая (щавелевая) кислота (НООС-СООН). При рассмотрении карбоксильной группы как заместителя, название двухосновной кислоты производят от названия углеводородного радикала с добавлением словосочетания "дикарбоновая кислота". Например, малоновую кислоту (НООС-СН2-СООН) называют метандикарбоновой кислотой. Изомерия. У карбоновых кислот возможны следующие виды изомерии: 1. Изомерия углеродной цепи. Она начинается с бутановой кислоты (С3Н7СООН), которая существует в виде двух изомеров:
2Изомерия положения кратной связи, например: СН2=СН—СН2—СООН СН3—СН=СН—СООН Цис-транс- изомерия, например:
цис -бутен-2-овая транс-бутен-2-овая 4. Межклассовая изомерия: например, масляной кислоте (СН3—СН2—СН2—СООН) изомерны метиловый эфир пропановой кислоты (СН3—СН2—СО—О—СН3) и этиловый эфир уксусной кислоты (СН3—СО—О—СН2—СН3). 5. У гетерофункциональных кислот имеется изомерия, связанная с положением функциональных групп, например, существуют три изомера хлормасляной кислоты: СН3—СН2—СНСl—СООН СН3—СНСl—СН2—СООН СН2Сl—СН2—СН2—СООН 4-хлорбутановая кислота.
22. Физические и химические свойства карбоновых кислот. Физические свойства. Насыщенные алифатические монокар-боновые кислоты образуют гомологический ряд, который характеризуется общей формулой CnH2n+1 COOH. Низшие члены этого ряда при обычных условиях представляют собой жидкости, обладающие характерным острым запахом. Например, этановая (уксусная) кислота имеет характерный "уксусный" запах. Безводная уксусная кислота при комнатной температуре представляет собой жидкость; при 17 °С она замерзает, превращаясь в льдистое вещество, которое получило название "ледяная" уксусная кислота. Средние представители этого гомологического ряда — вязкие, "маслообразные" жидкости; начиная с С10 — твердые вещества.Кислоты, содержащие 1-3 углеродных атома, неограниченно смешиваются с водой. Химические свойства. Карбоновые кислоты — более сильные кислоты, чем спирты, поскольку атом водорода в карбоксильной группе обладает повышенной подвижностью благодаря влиянию группы СО. В водном растворе карбоновые кислоты диссоциируют: RCOOH Тем не менее из-за ковалентного характера молекул карбоновых кислот указанное выше равновесие диссоциации достаточно сильно сдвинуто влево. Таким образом, карбоновые кислоты — это, как правило, слабые кислоты. 2. Образование солей. Карбоновые кислоты обладают всеми свойствами обычных кислот. Они реагируют с активными металлами, основными оксидами, основаниями и солями слабых кислот: Карбоновые кислоты — слабые, поэтому сильные минеральные кислоты вытесняют их из соответствующих солей:CH3COONa + HCl → СН3СООН + NaCl. Соли карбоновых кислот в водных растворах гидролизованы: СН3СООК + Н2О
Непредельные карбоновые кислоты способны к реакциям присоединения: СН2=СН-СООН + Н2 → СН3-СН2-СООН, СН2=СН-СООН + Сl2 → СН2Сl-СНСl-СООН, СН2=СН-СООН + HCl → СН2Сl-СН2-СООН, СН2=СН-СООН + Н2O → НО-СН2-СН2-СООН, 5. Окислительно-восстановительные реакции карбоновых кислот. Карбоновые кислоты при действии восстановителей в присутствии катализаторов способны превращаться в альдегиды, спирты и даже углеводороды:
Насыщенные карбоновые кислоты устойчивы к действию концентрированных серной и азотной кислот. Исключение составляет муравьиная кислота:
Муравьиная кислота НСООН отличается рядом особенностей, поскольку в ее составе есть альдегидная группа:
Муравьиная кислота — сильный восстановитель и легко окисляется до СО2. Она дает реакцию "серебряного зеркала": Кроме того, муравьиная кислота окисляется хлором:НСООН + Сl2 → СО2 + 2HCl. В атмосфере кислорода карбоновые кислоты окисляются до СО2 и Н2О:СН3СООН + 2О2 → 2СО2 + 2Н2О. 6. Реакции декарбоксширования. Насыщенные незамещенные монокарбоновые кислоты из-за большой прочности связи С—С при нагревании декарбоксилируются с трудом. Для этого необходимо сплавление соли щелочного металла карбоновой кислоты со щелочью:
23. Аминокислоты. Общая характеристика: строение, номенклатура, изомерия. Аминокислотами называют соединения, в которых одновременно содержатся аминная и карбоксильная группы. Простейшие аминокислоты имеют тривиальные названия. Обычно же их называют как замещённые соответствующих кислот, обозначая положение аминогрупп относительно кислотной буквами α, β, γ, δ и т. д. Используется также названия по номенклатуре ИЮПАК:
Аминокислоты могут содержать одну или несколько кислотных групп и различаться по основности. В молекулу аминокислоты может также входить и несколько аминогрупп. В зависимости от взаимного расположения амино- и карбоксильной групп аминокислоты подразделяют на α-, β-, γ-, δ-, ε- и т. д.
2. В зависимости от количества функциональных групп различают кислые, нейтральные и основные. 3. По характеру углеводородного радикала различают алифатические (жирные),ароматические,серосодержащие и гетероциклические аминокислоты. Приведенные выше аминокислоты относятся к жирному ряду. Примером ароматической аминокислоты может служить пара-аминобензойная кислота:
НОМЕНКЛАТУРа.По систематической номенклатуре названия аминокислот образуются из названий соответствующих кислот прибавлением приставки амино- и указанием места расположения аминогруппы по отношению к карбоксильной группе. Нумерация углеродной цепи с атома углерода карбоксильной группы. Например:
ИЗОМЕРИЯ1. Изомерия углеродного скелета
2. Изомерия положения функциональных групп
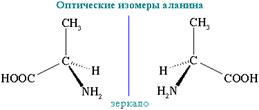
3. Оптическая изомерия
α-аминокислоты, кроме глицина NН2-CH2-COOH.
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 1727; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.116.28.79 (0.008 с.) |


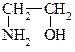 2-Аминоэтанол-1, моноэтаноламин, коламин
2-Аминоэтанол-1, моноэтаноламин, коламин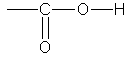 Классификация. По числу карбоксильных групп карбоновые кислоты делят на монокарбоновые, или одноосновные (одна группа -СООН), дикарбоновые, или двухосновные (две группы -СООН) и т.д. В зависимости от строения углеводородного радикала, с которым связана карбоксильная группа, карбоновые кислоты бывают алифатическими (например, уксусная или акриловая), алициклическими (например, циклогексанкарбоновая) или ароматическими (бензойная, фталевая). В таблице указаны некоторые представители карбоновых кислот. Номенклатура. В основе названий карбоновых кислот лежат названия соответствующих углеводородов. Наличие карбоксильной группы отражается окончанием -овая кислота. Низшие карбоновые кислоты часто имеют тривиальные названия: муравьиная, уксусная, масляная и др.Углеводородную цепь нумеруют начиная с атома углерода карбоксильной группы, например:
Классификация. По числу карбоксильных групп карбоновые кислоты делят на монокарбоновые, или одноосновные (одна группа -СООН), дикарбоновые, или двухосновные (две группы -СООН) и т.д. В зависимости от строения углеводородного радикала, с которым связана карбоксильная группа, карбоновые кислоты бывают алифатическими (например, уксусная или акриловая), алициклическими (например, циклогексанкарбоновая) или ароматическими (бензойная, фталевая). В таблице указаны некоторые представители карбоновых кислот. Номенклатура. В основе названий карбоновых кислот лежат названия соответствующих углеводородов. Наличие карбоксильной группы отражается окончанием -овая кислота. Низшие карбоновые кислоты часто имеют тривиальные названия: муравьиная, уксусная, масляная и др.Углеводородную цепь нумеруют начиная с атома углерода карбоксильной группы, например:

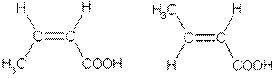
 RCOO- + Н+
RCOO- + Н+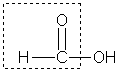


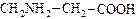
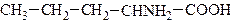



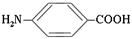 Примером гетероциклической аминокислоты может служить триптофан – незаменимая α- аминокислота
Примером гетероциклической аминокислоты может служить триптофан – незаменимая α- аминокислота