
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Предмет органической химии. Теория Бутлерова.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Содержание ЧАСТЬ 1
Предмет органической химии. Теория Бутлерова. Основным объектом изучения химии являются химические соединения и их превращения. Органическая химия – это обособленный раздел химической науки. Она изучает углеводороды и их производные, т. е. – соединения углерода с другими элементами, чаще всего с водородом, кислородом, азотом, серой, фосфором и галогенами. Такая приверженность одному элементу, углероду, обусловлена способностью углеродных атомов образовывать четыре ковалентные, а также кратные связи с атомами углерода и другими элементами, и склонностью соединяться в прямые и разветвленные цепи, которые могут включать от двух до нескольких тысяч атомов углерода.
Важными вехами в развитии теоретических представлений в органической химии явилось установление четырехвалентности углерода немецкими учеными Кекуле и Кольбе (1857 г.) и способности углерода образовывать цепочки атомов (Кекуле и Купер, 1857 г.) Осново-полагающей явилась теория химического строения органических соединений Александра Михайловича Бутлерова (1861г.). Сущность этой теории заключается в трех основных положениях: 1) все химические вещества имеют строго определенное химическое строение, то есть строго определенный порядок чередования атомов в молекуле, определенную закономерность во влиянии атомов друг на друга; 2) химическое строение веществ определяет их физические и химические свойства; Изучение свойств веществ позволяет определить их химическое строение. Теория химического строения позволила классифицировать весь накопившийся экспериментальный материал, предсказала возможное число органических соединений одного определенного состава (изомерия) и пути их синтеза. В XX веке она получила обоснование с позиций квантовой механики. Позднее (1877 г.) теория строения была дополнена Вант-Гоффом и Ле Белем теорией пространственного расположения атомов в молекулах – стереохимической теорией.
Классификация органических соединений. Основы номенклатуры.
Существование гомологии и гомологических рядов существенно облегчает классификацию и изучение органических соединений. Гомологическим рядом называется ряд веществ, отличающихся друг от друга на любое число групп СН2, имеющих сходное строение и свойства. В зависимости от строения углеродной цепи органические соединения делятся на соединения с открытой цепью (это алифатический, или жирный ряд) и циклические соединения. Циклические соединения могут быть карбоциклическими (циклы составлены только из атомов углерода) и гетероциклическими (циклы содержат кроме углерода и другие атомы). В свою очередь, карбоциклические соединения включают алициклический и ароматический ряды. Наиболее простыми соединениями алифатического, алициклического и ароматических рядов являются углеводороды В зависимости от наличия в соединении функциональной группы определенной природы можно выделить следующие главнейшие классы органических соединений:
– углеводороды; – галогенпроизводные; – гидроксисоединения; – простые эфиры; – карбонильные соединения (альдегиды и кетоны); – карбоновые кислоты; – амины; – нитросоединения; – сульфокислоты; – элементорганические соединения. Для наименования отдельных органических соединений широкое распространение получили тривиальные названия, рациональная, В 1947 г. на совещании Международного союза чистой и прикладной химии (International Union of Pure and Applied Chemistry — сокращенно IUPAC), состоявшемся в Лондоне, было принято решение о пересмотре существовавших правил номенклатуры органических соединений и о выработке новых международных правил. Созданная комиссия выработала правила, которые в 1957 г. были опубликованы под названием Правила номенклатуры органических соединений IUPAC 1957. В СССР А. П. Терентьевым с сотрудниками (1951 г.) была предложена систематическая номенклатура,основанная на строгом едином принципе и позволяющая однозначно называть любое органическое соединение.
Физические и химические свойства алканов. Методы получения и идентификации алканов. Отдельные представители. Физические свойства алканов. Первые четыре члена ряда – метан, этан, пропан и бутан – при комнатных условиях газы. Алканы С5–С15 – жидкие, а С16 и далее – твердые. В обычных условиях Химические свойства алканов Углеводороды ряда метана при обыкновенной температуре химически весьма инертны. Они не присоединяют водород (отсюда – предельные), не реагируют без инициирования с Cl2 и Br2, не окисляются на холоду такими сильными окислителями, как перманганат калия и хромовая кислота В то же время эти связи сравнительно легко подвергаются гомолитическому разрыву с образованием радикалов. Поэтому для алканов в большей мере свойственны реакции радикального замещения. – Галоидирование На свету алканы могут последовательно замещать атомы водорода на атомы галоида, например: При температуре» 500 °С метан под воздействием азотной кислоты и двуокиси азота нитруется: – Сульфирование Серная кислота (олеум) при нагревании медленно сульфирует алканы с третичным атомом углерода: – Сульфохлорирование Под действием ультрафиолетового освещения алканы вступают в реакцию замещения со смесью SO2 + Cl2: – Окисление У изоалканов сравнительно легко окисляется третичная группа СН. Промышленный интерес представляет каталитическое окисление смеси высших предельных углеводородов С8 – С18:
– Дегидрирование При t = 300 °C…400 °С алканы, пропущенные над катализатором теряют два атома водорода и превращаются в алкены:
– Изомеризация Под действием кислых катализаторов (например, AlCl3, H2SO4 и др.) алканы способны к перестройке углеродного скелета:
Способы получения алканов – Гидрирование ненасыщенных углеводородов – Из галоидных алкилов ( реакция Вюрца, 1870 г.) – Из карбоновых кислот – Крекинг и пиролиз алканов нефти:
5. Алкены. Общая характеристика: строение, изомерия, номенклатура.
Гомологический ряд алкенов начинается с этилена. Алкены (олефины, этиленовые углеводороды)– углеводороды, которые содержат в молекуле одну двойную связь. Общая формула – CnH2n.
Изомерия. Номенклатура Как и в ряду предельных углеводородов структурная изомерия алкенов начинается с четвертого члена ряда. Однако число изомеров значительно больше. Изомерия олефинов обусловлена строением углеродной цепи, во-вторых – положением двойной связи в цепи и в-третьих – пространственным расположением атомов или групп при углеродах с двойной связью Называют алкены по различным номенклатурам. В тривиальной номенклатуре к названию соответствующего радикала предельного углеводорода добавляют суффикс –ен: этилен, пропилен, бутилен, изобутилен, амилен и т.д. По рациональной номенклатуре олефины называются как производные этилена. При составлении названия по номенклатуре ИЮПАК в качестве основной цепи соединения выбирается самая длинная углеродная цепочка, включающая двойную связь. За основу названия берется название алкана с заменой окончания -ан на Например: СН2=СН2 этилен; этен
Способы получения – Основным промышленным источником олефинового сырья являются процессы крекинга и пиролиза нефтяных фракций. Эти процессы дают смесь легких газообразных алкенов С2 – С5, которая сжижается при пониженной температуре и повышенном давлении и разгоняется на фракции С2, С3, С4. Реакция в последнем случае протекает при температуре ~300 °С на катализаторе оксид хрома:
– Дегидратация спиртов. Это обычный лабораторный способ получения этиленовых углеводородов. – Из галогенпроизводных отщеплением галогенов или галогеноводородов. – Гидрирование соединений с тройной связью (ацетиленов) над не очень Физические свойства некоторых алкенов показаны в табл. 1. Первые три представителя гомологического ряда алкенов (этилен, пропилен и бутилен) — газы, начиная с C5H10(амилен, или пентен-1) — жидкости, а с С18Н36 — твердые вещества Химические свойства алкенов. Для алкенов наиболее типичными являются реакции присоединения. В реакциях присоединения двойная связь выступает как донор электронов, поэтому для алкенов характерны реакции электрофильного присоединения. Реакции присоединения 1. Гидрирование (гидрогенизация – взаимодействие с водородом): CnH2n + H2 t, Ni → CnH2n+2 2. Галогенирование (взаимодействие с галогенами): CnH2n + Г2 → СnH2nГ2
Это качественная реакция алкенов – бромная вода Br2 (бурая жидкость) обесцвечивается.
3. Гидрогалогенирование
4. Гидратация* (присоединение молекул воды):
CH2=CH2 + H2O t,H3PO4→ CH3-CH2-OH (этанол – этиловый спирт) 5. Реакции полимеризации: nCH2=CH2 t, p, kat-TiCl4, Al(C2H5)3 → (-CH2-CH2-)n мономер - этилен полимер – полиэтилен
Реакции окисления 1. Горение: CnH2n + 3n/2O2 t, p, kat → nCO2 + nH2O + Q (пламя ярко светящее) Частичное окисление этилена
2. Окисление перманганатом калия (р. Вагнера) в нейтральной среде– этокачественная реакция алкенов, розовый раствор марганцовки обесцвечивается.
Влияние среды на характер продуктов реакций окисления 1) Окисление в кислой среде при нагревании идёт до а) карбоновых кислот; б) кетонов (если атом углерода при двойной связи содержит два заместителя); в) углекислого газа (если двойная связь на конце молекулы, то образуется муравьиная кислота, которая легко окисляется до CO2): а) 5CH3-CH=CH-CH3 + 8KMnO4 + 12H2SO4 → 10CH3COOH + 8MnSO4 +4K2SO4 + 12H2O
в) CH3 – CH2 – CH = CH2 + 2KMnO4 + 3H2SO4 → CH3CH2COOH + CO2 + 2MnSO4 + K2SO4 + 4H2O
Изомерия и номенклатура Изомерия ацетиленов определяется положением тройной связи и строением углеродного скелета. Называют ацетиленовые углеводороды по номенклатуре ИЮПАК и по так называемой «ацетиленовой» номенклатуре. По «ацетиленовой» номенклатуре названия гомологов ацетилена строятся прибавлением к ацетилену названий радикалов, замещающих в нём атомы водорода. В случае номенклатур ИЮПАК пользуются теми же правилами, что и при названии олефинов, только окончание - ен заменяется на -ин.
Отдельные представители
Ацетилен В последние десятилетия ацетилен получил очень широкое применение в промышленности. Частично при рассмотрении химических свойств состоялось знакомство с областями его использования. Из ацетилена получают пластмассы, каучук, растворители, он используется для ацетиленовой сварки и резки металлов и т. д. Винилацетилен получается из ацетилена и как побочный продукт пиролиза метана на ацетилен. Подобно дивинилу он присоединяет в 1,2 – и 1,4 – положения. Диацетилен В технике получается как побочный продукт пиролиза метана. Диацетилен очень активен в реакциях присоединения. Например:
На базе диацетилена получено много технически ценных продуктов. Изомерия и номенклатура Первый член ряда углеводородов с одним бензольным циклом – бензол, второй – метилбензол или толуол. Третий член ряда – ксилол – имеет три структурных изомера: орто-, мета- и пара-.
Изомерия производных бензола зависит как от величины и числа заместителей, так и от их относительного расположения. Так, при одинаковых заместителях бензол и однозамещённый бензол не имеют изомеров, ди- и тризамещённый – имеют по три изомера.
Если заместители разные, число изомеров, начиная с тризамещённого бензола, резко возрастает. Кроме того, источником изомерии может явиться сам заместитель.
Для названия углеводородов ароматического ряда и их производных применяются тривиальная, радикально-функциональная и ИЮПАК номенклатуры. В радикально-функциональной номенкла-туре используются названия следующих радикалов:
В номенклатуре ИЮПАК перед названием углеводорода проставляются названия заместителей с номерами углеродных атомов, которые несут эти заместители. Например:
При двух заместителях в бензольном цикле их взаимное расположение в цикле обозначается не только цифрами (счет идет по кратчайшему пути от одного к другому), но и с помощью приставок орто-, мета-, пара-, обозначающих соответственно 1,2-, 1,3- и 1,4- относительные положения.
Отдельные представители Бензол – жидкость, tплав.= 5,4 °С, tкип= 80,1 °С, с водой образует азеотропную смесь, поэтому при перегонке легко обезвоживается. В промышленности имеет чрезвычайно широкое применение: как растворитель, для получения производных бензола и других соединений (хлорпроизводных, анилина, фенола, красителей, взрывчатых веществ, лечебных препаратов, капрона, нейлона, ацетона, полистирола и т.д.). Толуол – жидкость, tплав.= –93 °С, tкип= 110,6 °С. Главное применение – производство взрывчатых веществ (тротил: тринитро-толуол), бензойного альдегида, хлористого бензила, которые служат сырьем для анилинокрасочной, парфюмерной, пищевой и других отраслей промышленности. Используется как растворитель. Ксилолы. Смесь ксилолов используется как растворитель и для повышения октанового числа моторных топлив (ОЧ ≥ 120). Большое количество пара -ксилола идет на производство синтетического волокона лавсан. Получают ксилолы, главным образом, риформингом узких нефтяных фракций с пределами выкипания близкими к температуре кипения ксилолов. Этилбензол. Получают алкилированием бензола этиленом в присутствии AlCl3. Используется в основном для получения стирола (винилбензола) Многоатомные спирты Многоатомные спирты - спирты, имеющие несколько гидроксильных групп OH. 1. Получение этилового спирта (или винный спирт) путём брожения углеводов: Суть брожения заключается в том, что один из простейших сахаров - глюкоза, получаемый в технике из крахмала, под влиянием дрожжевых грибков распадается на этиловый спирт и углекислый газ. Установлено, что процесс брожения вызывают не сами микроорганизмы, а выделяемые ими вещества - зимазы. Для получения этилового спирта обычно используют растительное сырьё, богатое крахмалом: клубни картофеля, хлебные зёрна, зёрна риса и т.д. 2. Гидратация этилена в присутствии серной или фосфорной кислоты 3. При реакции галогеналканов со щёлочью: 5. Гидролиз жиров: в этой реакции получается всем известный спирт - глицерин Свойства спиртов 1) Горение: Как и большинство органических веществ спирты горят с образованием углекислого газа и воды: 2) Реакция со щелочными металлами 3) Реакция с галогеноводородом C2H5-OH + HBr --> CH3-CH2-Br + H2O 4) Внутримолекулярная дегидратация (в присутствии катализатора H2SO4) 5) реакция с карбоновыми кислотами: 6) Окисление спиртов. Кислородом воздуха при обычной температуре спирты не окисляются, но при нагревании в присутствии катализаторов идёт окисление. Примером может служить оксид меди (CuO), марганцовка (KMnO4), хромовая смесь. При действии окислителей получаются различные продукты и зависят от строения исходного спирта. Так, первичные спирты превращаются в альдегиды (реакция А), вторичные - в кетоны (реакция Б), а третичные спирты устойчивы к действию окислителей. Что касается многоатомных спиртов, то они имеют сладковатый вкус, но некоторые из них ядовиты. Свойства многоатомных спиртов похожи на одноатомные спирты, при этом различие в том, что реакция идёт не по одной к гидроксильной группе, а по нескольким сразу.
Биологическая роль белков 1. Ферментативная (каталитическая). В биологических системах почти все реакции катализируются специфическими белками – ферментами. 2. Строительная, структурная функция. Белки образуют основу протоплазмы любой живой клетки, в комплексе с липидами они являются основным структурным материалом всех клеточных мембран всех органелл. 3. Двигательная функция. Любые формы движения в живой природе (работа мышц, движение ресничек и жгутиков у простейших, движение протоплазмы в клетке и т.д.) осуществляется белковыми структурами. 4. Транспортная функция. Перенос различных молекул, ионов осуществляется специфическими белками. 5. Регуляторная функция. Регуляция углеводного, белкового, липидного обменов осуществляется с помощью гормонов, которые по своему строению относятся к белкам (инсулин) или пептидам (окситоцин, вазопрессин и др.). 6. Защитная – эту функцию выполняют иммуноглобулины (антитела). Они обладают способностью обезвреживать бактерии, вирусы, чужеродные белки, попавшие в организм извне. 7. Фоторецепторные белки: например, родопсин, участвующий в зрительных процессах. 8. Резервные белки используются, как запасной материал для питания развивающегося зародыша и новорожденного организма – это белки семян зернобобовых культур, альбумин – яичный белок, казеин молока. Ферретин – белок животных тканей в котором запасено железо. Резервные белки являются важнейшими компонентами растительной и животной пищи. Основными источниками незаменимых аминокислот являются белки животного происхождения (молоко, творог, мясо, яйца, рыба). В продуктах растительного происхождения (мука, крупы, бобовые) белки не содержат полного набора незаменимых аминокислот или содержат их в недостаточном количестве. Вместе с тем, растительные белки обладают низкой усвояемостью (60% против 90% у животных белков).
Инверсия сахарозы При гидролизе сахарозы она расщепляется на эквимолекулярные количества D-(+)-глюкозы и D-(–)-фруктозы. ФУНКЦИИ ЛИПИДОВ В организме липиды выполняют пять основных функций: 1) энергетическую – являются резервными соединениями, основной формой запасания энергии и углерода. При окислении 1г нейтральных жиров (триацилглицеролов) выделяется около 38 кДж энергии; 2) защитную – липиды (воски) образуют защитные водоотталкивающие покровы растений, их семян и плодов и термоизоляционные (жир) прослойки у животных организмов; 3) структурную – являются главными структурными компонентами клеточных мембран; 4) липиды служат предшественниками ряда других биологически активных веществ – витамина Д, желчных кислот, каротиноидов, стеролов и т.д.; 5) регуляторную – производными жирных кислот являются стероидные гормоны и простагландины – гормоны местного действия. От свойств и структуры мембранных липидов во многом зависит активность мембраносвязанных ферментов. Липидами являются жирорастворимые витамины и провитамины (каротины, стеролы); обладая высокой биологической активностью, эти вещества оказывают регулирующее влияние на обмен веществ. КЛАССИФИКАЦИЯ ЛИПИДОВ Существует несколько классификаций липидов. Наибольшее распространение получила классификация, основанная на структурных особенностях липидов и их способности к гидролизу (рисунок 1).
Рисунок 1 – Классификация липидов Мыла и детергенты. Омыление жиров с помощью гидроксида натрия или гидроксида калия проводится главным образом при получении мыла. Мыла представляют собой щелочные соли высших жирных кислот: СН2—ОСОС17Н35 СН2ОН | | СН—ОСОС17Н35 + 3NaOH ® СНОН + 3C17H35COONa | | стеарат натрия (мыло) СН2—ОСОС17Н35, СН2ОН
В промышленности в качестве исходных веществ для их получения применяются животные жиры, хлопковое, пальмовое, кокосовое масла, гидрогенизиро- ванные жиры. При нагревании их с гидроксидом натрия образуется густой раствор («мыльный клей»), содержащий глицерин и соли жирных кислот. Затем к еще горячей жидкости прибавляют поваренную соль — «высаливают» натриевое мыло. Все мыла, являясь щелочными солями слабых кислот, в воде частично гидролизуются с образованием свободной жирной кислоты и гидроксида щелочного металла, поэтому их растворы имеют щелочную реакцию: C17H35COONa + Н20 ®С17Н35С00Н + NaOH. При добавлении натриевого мыла к жесткой воде ионы кальция и магния замещают ионы натрия, образуя нерастворимые и поэтому не обладающие моющим действием кальциевые и магниевые мыла. Поэтому моющая способность мыла в жесткой воде значительно снижается. Одним из способов смягчения «жесткой» (содержащей ионы Са2ч~, Mg2+и Fe3+) воды является обработка ее хелатирующими агентами. Чаще всего используют ЭДТА — этилендиаминтетрауксусную кислоту, которая связывает, например, Са2+ в устойчивый растворимый в воде хелат Детергенты В продаже под различными названиями имеются моющие средства (детергенты), заменители мыл, представляющие собой, например, смесь натриевых солей эфиров серной кислоты и высших спиртов (главным образом лаурилового и цетилового): R—S03Na, где R — от С10 до С16. Эти соединения (а также часто применяемые для этих целей алкансульфонаты R—S03Na, где R — от С10 до С1б) можно использовать и в жесткой воде, так как они не образуют нерастворимых соединений с кальцием и магнием; они не обладают сильными щелочными свойствами и поэтому не повреждают тканей. Свойства мыла или детергента заметно изменяются и в зависимости от природы противоположно заряженного иона, свободно перемещающегося в водной среде. Производство детергентов непрерывно растет, а доля мыл в производстве моющих и чистящих средств постоянно сокращается. Это позволит высвободить значительное количество низкокачественных жиров для питания сельскохозяйственных животных. Омыление жиров с помощью гидроксида натрия или гидроксида калия проводится главным образом при получении мыла. Мыла представляют собой щелочные соли высших жирных кислот:
СН2—ОСОС17Н35 СН2ОН | | СН—ОСОС17Н35 + 3NaOH ® СНОН + 3C17H35COONa | | стеарат натрия (мыло) СН2—ОСОС17Н35, СН2ОН
Содержание ЧАСТЬ 1
Предмет органической химии. Теория Бутлерова. Основным объектом изучения химии являются химические соединения и их превращения. Органическая химия – это обособленный раздел химической науки. Она изучает углеводороды и их производные, т. е. – соединения углерода с другими элементами, чаще всего с водородом, кислородом, азотом, серой, фосфором и галогенами. Такая приверженность одному элементу, углероду, обусловлена способностью углеродных атомов образовывать четыре ковалентные, а также кратные связи с атомами углерода и другими элементами, и склонностью соединяться в прямые и разветвленные цепи, которые могут включать от двух до нескольких тысяч атомов углерода. Важными вехами в развитии теоретических представлений в органической химии явилось установление четырехвалентности углерода немецкими учеными Кекуле и Кольбе (1857 г.) и способности углерода образовывать цепочки атомов (Кекуле и Купер, 1857 г.) Осново-полагающей явилась теория химического строения органических соединений Александра Михайловича Бутлерова (1861г.). Сущность этой теории заключается в трех основных положениях: 1) все химические вещества имеют строго определенное химическое строение, то есть строго определенный порядок чередования атомов в молекуле, определенную закономерность во влиянии атомов друг на друга; 2) химическое строение веществ определяет их физические и химические свойства;
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 5013; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.149.14 (0.019 с.) |

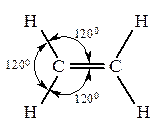





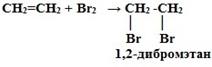
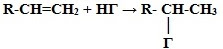
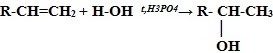
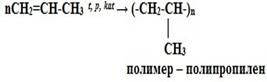





 C6H4
C6H4
 C6H5CH
C6H5CH




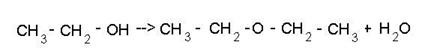

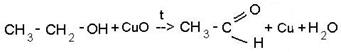

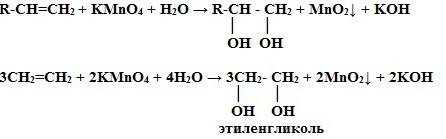
 Этиленгликоль - типичный представитель многоатомных спиртов. Его химическая формула CH2OH - CH2OH. - двухатомный спирт. Это сладкая жидкость, которая способно отлично растворяться в воде в любых пропорциях. В химических реакциях может участвовать как одна гидроксильная группа (-OH), так и две одновременно.Этиленгликоль - его растворы - широко применяются как антиобледенительное средство (антифризы). Раствор этиленгликоля замерзает при температуре -340C, что в холодное время года может заменить воду, например для охлаждения автомобилей.
Этиленгликоль - типичный представитель многоатомных спиртов. Его химическая формула CH2OH - CH2OH. - двухатомный спирт. Это сладкая жидкость, которая способно отлично растворяться в воде в любых пропорциях. В химических реакциях может участвовать как одна гидроксильная группа (-OH), так и две одновременно.Этиленгликоль - его растворы - широко применяются как антиобледенительное средство (антифризы). Раствор этиленгликоля замерзает при температуре -340C, что в холодное время года может заменить воду, например для охлаждения автомобилей.



