
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Физические и химические свойства алкинов. Методы получения.Содержание книги
Поиск на нашем сайте
Способы получения. Рассмотрим вначале методы промышленного получения ацетилена. – До недавнего времени основным источником ацетилена служил карбид кальция СаС2. Ацетилен получается при разложении карбида кальция водой:
– Пиролиз углеводородов Пиролиз метана осуществляется нагреванием природного газа до температуры 1400 °C. Он приводит к образованию ацетилено-водо-родной смеси.
Метод также энергоёмок. – При окислительном пиролизе с добавкой кислорода часть метана расходуется на раскаливание аппарата, а остальной метан подвергается пиролизу.
– Пиролиз жидких углеводородов при температурах Ацетилен и его гомологи могут быть получены также следующими способами. – Действием спиртовой щёлочи на дигалогеналканы и галогеналкены. – Алкилированием металлических производных ацетилена.
Физические свойства. Температуры кипения и плавления алкинов, так же как и алкенов, закономерно повышаются при увеличении молекулярной массы соединений. Алкины имеют специфический запах. Они лучше растворяются в воде, чем алканы и алкены. Химические свойства.Реакции присоединения. Алкины относятся к непредельным соединениям и вступают в реакции присоединения. В основном это реакции электрофильного присоединения. 1. Галогенирование (присоединение молекулы галогена). Алкин способен присоединить две молекулы галогена (хлора, брома).
2. Гидрогалогенирование (присоединение галогеноводорода). Реакция присоединения галогеноводорода, протекающая по электрофильному механизму, также идет в две стадии, причем на обеих стадиях гидрогалогенирования выполняется правило Марковникова:
3. Гидратация (присоединение воды). Большое значение для промышленного синтеза кетонов и альдегидов имеет реакция присоединения воды (гидратация), которую называют реакцией Кучерова:
4. Гидрирование алкинов. Алкины присоединяют водород в присутствии металлических катализаторов (Pt, Pd, Ni):
Окисление алкинов. Этин (ацетилен) горит в кислороде с выделением очень большого количества теплоты:
На этой реакции основано действие кислородноацетиленовой горелки, пламя которой имеет очень высокую температуру (более 3000 °С), что позволяет использовать ее для резки и сварки металлов.На воздухе ацетилен горит коптящим пламенем, т. к. содержание углерода в его молекуле выше, чем в молекулах этана и этена. Алкины, как и алкены, обесцвечивают подкисленные растворы перманганата калия; при этом происходит разрушение кратной связи. Ароматические углеводороды. Арены. Общая хар-ка: строение, номен., класс. Ароматические углеводороды представляют собой большую группу веществ, содержащих в своей структуре чаще всего бензольный цикл или систему нескольких бензольных циклов. В рассмотренной ранее схеме последовательного дегидрирования циклогексана до циклегексена, циклогексадиена и циклегексатриена (бензола) первые две стадии эндотермичны, а стадия дегидрирования циклогексадиена с образованием бензола протекает с выделением энергии, что указывает на необычайно высокую энергетическую устойчивость бензола по отношению к другим участникам реакции и обуславливает специфические химические и физические свойства соединения, его так называемый ароматичеcкий характер.
Ароматический ряд объединяет соединения различных классов: углеводороды, галоген-, гидроксил-, карбонилпроизводные, карбоновые кислоты, амины и т.д. Вещества всех этих классов являются производными ароматических углеводородов. Изомерия и номенклатура Первый член ряда углеводородов с одним бензольным циклом – бензол, второй – метилбензол или толуол. Третий член ряда – ксилол – имеет три структурных изомера: орто-, мета- и пара-.
Изомерия производных бензола зависит как от величины и числа заместителей, так и от их относительного расположения. Так, при одинаковых заместителях бензол и однозамещённый бензол не имеют изомеров, ди- и тризамещённый – имеют по три изомера.
Если заместители разные, число изомеров, начиная с тризамещённого бензола, резко возрастает. Кроме того, источником изомерии может явиться сам заместитель.
Для названия углеводородов ароматического ряда и их производных применяются тривиальная, радикально-функциональная и ИЮПАК номенклатуры. В радикально-функциональной номенкла-туре используются названия следующих радикалов:
В номенклатуре ИЮПАК перед названием углеводорода проставляются названия заместителей с номерами углеродных атомов, которые несут эти заместители. Например:
При двух заместителях в бензольном цикле их взаимное расположение в цикле обозначается не только цифрами (счет идет по кратчайшему пути от одного к другому), но и с помощью приставок орто-, мета-, пара-, обозначающих соответственно 1,2-, 1,3- и 1,4- относительные положения.
|
|||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 877; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.169 (0.007 с.) |






 C6H4
C6H4
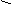
 C6H5CH
C6H5CH



