
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Общая характеристика: номенклатура и изомерия двухатомных спиртов. Физические и химические свойства.Содержание книги
Поиск на нашем сайте
Спирты, содержащие несколько гидроксильных групп, называются многоатомными. Различают двух-, трех-, четырехатомные и т. д. спирты. Двухатомные спирты называют гликолями, трехатомные – глицеринами. Гликоли. Гидроксильные группы в гликолях содержатся у различных атомов углерода. Гликоли с двумя гидроксилами у одного углеродного атома нестойки. Они отщепляют воду с образованием альдегидов или кетонов. Изомерия гликолей определяется взаимным расположением гидроксильных групп и изомерией углеродного скелета. В зависимости от взаимного расположения групп OH– различают α-, β-, γ-, δ-, … гликоли. В зависимости от характера углеродных атомов, несущих гидроксилы, гликоли могут быть первично-вторичными, первично-третичными, двупервичными, двувторичными и т.д. Названия гликолей могут даваться двумя способами. По номенклатуре ИЮПАК к названию основной углеродной цепи добавляют суффикс –диол иуказывают номера углеродных атомов самой длинной углеродной цепи, несущих гидроксильные группы. Названия α- гликолей могут производиться от названия соответствующего этиленового углерода с добавлением слова гликоль. Классификация и названия гликолей даны ниже на примере бутандиолов:
Способы получения. В принципе, гликоли могут быть получены всеми обычными синтетическими методами получения спиртов. Примером могут служить следующие реакции. – Гидролиз дигалогенпроизводных насыщенных углеводо-родов и галогенгидринов:
– Гидратация α -окисей в кислой среде:
– Окисление олефинов перманганатом калия в разбавленном водном слабощелочном растворе (реакция Вагнера) или пероксидом водорода в присутствии катализаторов (CrO3):
Физические свойства. Низшие гликоли хорошо растворимы в воде. Плотность их выше, чем у одноатомных спиртов. Соответственно выше и температуры кипения из-за значительной ассоциации молекул: например, этиленгликоль кипит при температуре 197,2 °C; пропиленгликоль – при температуре 189 °C и бутандиол-1,4 – при температуре 230 °C. Химические свойства. Все сказанное ранее о свойствах соответствующих одноатомных спиртов приложимо и к гликолям. При этом следует помнить, что в реакцию может вступать как один гидроксил, так и сразу оба. – Окисление двупервичных гликолей дает альдегиды:
– При окислении α- гликолей йодной кислотой происходит разрыв связи между углеродными атомами, несущими гидроксилы, и образование соответствующих альдегидов или кетонов:
Метод имеет большое значение для установления строения α- гликолей. –Результаты внутримолекулярного отщепления воды отгликолей в значительной мере зависят от типа гликоля. Дегидратация α-гликолей протекает с образованием альдегидов или кетонов, γ-гликоли за счет атомов гидроксильных групп отщепляют воду с образованием гетероциклических соединений – тетрагидрофурана или его гомологов:
Первая реакция идёт через образование карбониевого иона с последующим перемещением атома водорода с его электронной парой:
При парофазной дегидратации над Al2O3 α- двутретичных гликолей, называемых пинаконами, получаются диеновые углеводороды:
– Межмолекулярная дегидратация приводит к образованию гидроксиэфиров или циклических простых эфиров:
Температура кипения диэтиленгликоля 245,5 °C. Его используют как растворитель для заполнения тормозных гидравлических систем, при отделке и крашении тканей. Среди циклических простых эфиров наибольшее распространение как растворитель получил диоксан. Он получен впервые А.Е. Фаворским нагреванием этиленгликоля с серной кислотой:
В смеси с водой этиленгликоль сильно понижает температуру её замерзания. Например, 60 %-ный водный раствор гликоля замерзает при температуре – 49 °C и с успехом применяется как антифриз. Большая гигроскопичность этиленгликоля используется для приготовления печатных красок. Большое количество этиленгликоля идёт на получение пленкообразующих материалов, лаков, красок, синтетических волокон (например, лавсана – полиэтилентерефталата), диоксана, диэтиленгликоля и других продуктов.
Многоатомные спирты Многоатомные спирты - спирты, имеющие несколько гидроксильных групп OH. 1. Получение этилового спирта (или винный спирт) путём брожения углеводов: Суть брожения заключается в том, что один из простейших сахаров - глюкоза, получаемый в технике из крахмала, под влиянием дрожжевых грибков распадается на этиловый спирт и углекислый газ. Установлено, что процесс брожения вызывают не сами микроорганизмы, а выделяемые ими вещества - зимазы. Для получения этилового спирта обычно используют растительное сырьё, богатое крахмалом: клубни картофеля, хлебные зёрна, зёрна риса и т.д. 2. Гидратация этилена в присутствии серной или фосфорной кислоты 3. При реакции галогеналканов со щёлочью: 5. Гидролиз жиров: в этой реакции получается всем известный спирт - глицерин Свойства спиртов 1) Горение: Как и большинство органических веществ спирты горят с образованием углекислого газа и воды: 2) Реакция со щелочными металлами 3) Реакция с галогеноводородом C2H5-OH + HBr --> CH3-CH2-Br + H2O 4) Внутримолекулярная дегидратация (в присутствии катализатора H2SO4) 5) реакция с карбоновыми кислотами: 6) Окисление спиртов. Кислородом воздуха при обычной температуре спирты не окисляются, но при нагревании в присутствии катализаторов идёт окисление. Примером может служить оксид меди (CuO), марганцовка (KMnO4), хромовая смесь. При действии окислителей получаются различные продукты и зависят от строения исходного спирта. Так, первичные спирты превращаются в альдегиды (реакция А), вторичные - в кетоны (реакция Б), а третичные спирты устойчивы к действию окислителей. Что касается многоатомных спиртов, то они имеют сладковатый вкус, но некоторые из них ядовиты. Свойства многоатомных спиртов похожи на одноатомные спирты, при этом различие в том, что реакция идёт не по одной к гидроксильной группе, а по нескольким сразу.
|
||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 3525; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.44.233 (0.009 с.) |













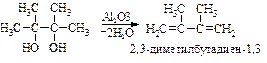

 Этиленгликоль – это вязкая бесцветная жидкость, сладковатая на вкус, tкип = 197,2 °C. В промышленных масштабах получается из этилена по трем схемам.
Этиленгликоль – это вязкая бесцветная жидкость, сладковатая на вкус, tкип = 197,2 °C. В промышленных масштабах получается из этилена по трем схемам.



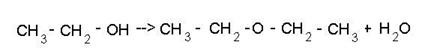

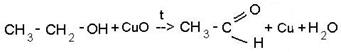

 Этиленгликоль - типичный представитель многоатомных спиртов. Его химическая формула CH2OH - CH2OH. - двухатомный спирт. Это сладкая жидкость, которая способно отлично растворяться в воде в любых пропорциях. В химических реакциях может участвовать как одна гидроксильная группа (-OH), так и две одновременно.Этиленгликоль - его растворы - широко применяются как антиобледенительное средство (антифризы). Раствор этиленгликоля замерзает при температуре -340C, что в холодное время года может заменить воду, например для охлаждения автомобилей.
Этиленгликоль - типичный представитель многоатомных спиртов. Его химическая формула CH2OH - CH2OH. - двухатомный спирт. Это сладкая жидкость, которая способно отлично растворяться в воде в любых пропорциях. В химических реакциях может участвовать как одна гидроксильная группа (-OH), так и две одновременно.Этиленгликоль - его растворы - широко применяются как антиобледенительное средство (антифризы). Раствор этиленгликоля замерзает при температуре -340C, что в холодное время года может заменить воду, например для охлаждения автомобилей.


