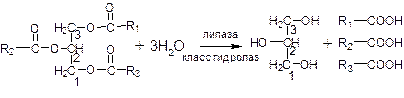Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Прогоркание жира. Аналитическая характеристика жиров.Содержание книги
Поиск на нашем сайте
При хранении растительные масла, животные жиры, а также жиросодержащие продукты (мука, крупа, кондитерские изделия, мясные продукты) под влиянием кислорода воздуха, света, ферментов, влаги приобретают неприятный вкус и запах. Иными словами, жир прогоркает. Прогоркание жиров и жиросодержащих продуктов – результат сложных химических и биохимических процессов, протекающих в липидном комплексе. В зависимости от характера основного процесса, протекающего при этом, различают гидролитическое и окислительное прогоркание. Каждый из них может быть разделен на автокаталитическое (неферментативное) и ферментативное (биохимическое) прогоркание. ГИДРОЛИТИЧЕСКОЕ ПРОГОРКАНИЕ При гидролитическом прогоркании происходит гидролиз жира с образованием глицерина и свободных жирных кислот.
ОКИСЛИТЕЛЬНОЕ ПРОГОРКАНИЕ. Наиболее распространенным видом порчи жиров в процессе хранения является окислительное прогоркание. АНАЛИТИЧЕСКАЯ ХАРАКТЕРИСТИКА ЖИРОВ Кроме температуры плавления и затвердевания, для характеристики жиров применяются следующие величины: кислотное число, перекиснре число, число омыления, йодное число. Под действием ферментов липазы и липоксигеназы изменяется качество жиров и масел, которое характеризуется следующими показателями или числами: Кислотное число (К.ч.) – это количество миллиграммов гидроксида калия, необходимого для нейтрализации свободных жирных кислот в 1 г жира. Йодное число (Й.ч.) – это количество граммов йода, присоединившегося по месту двойных связей к 100 г жира. Йодное число позволяет судить о степени ненасыщенности масла (жира), о склонности его к высыханию, прогорканию и другим изменениям, происходящим при хранении. Перекисное число (П.ч.) показывает количество перекисей в жире, выражают его в процентах йода, выделенного из йодистого калия перекисями, образовавшимися в 1 г жира. В свежем жире перекиси отсутствуют, но при доступе воздуха они появляются сравнительно быстро. В процессе хранения перекисное число увеличивается. Число омыления (Ч.о.) – равно числу миллиграммов гидроксида калия, расходующихся при омылении 1г. жира кипячением последнего с избытком гидроксида калия в спиртовом растворе. Полимеризация масел. Важными являются реакции автоокисления и полимеризации масел. По этому признаку растительные масла делятся на три категории: высыхающие, полувысыхающие и невысыхающие. Высыхающие масла в тонком слое обладают способностью образовывать на воздухе эластичные, блестящие, гибкие и прочные пленки, нерастворимые в органических растворителях, устойчивые к внешним воздействиям. На этом свойстве основано использование этих масел для приготовления лаков и красок. Основной характерной чертой высыхающих масел является высокое содержание непредельных кислот. Для оценки качества высыхающих масел применяют йодное число (оно должно быть не менее 140). Процесс высыхания масел заключается в окислительной полимеризации. Все ненасыщенные эфиры жирных кислот и их глицериды окисляются на воздухе. Высыхающие масла, содержащие глицериды ненасыщенных кислот с двумя или тремя двойными связями, служат для приготовления олифы. Для получения олифы льняное масло нагревают до 250—300 °С в присутствии катализаторов. Полувысыхающие масла (подсолнечное, хлопковое) отличаются от высыхающих меньшим содержанием непредельных кислот (йодное число 127—136). Невысыхающие масла (оливковое, миндальное) имеют йодное число ниже 90 (например, для оливкового масла 75—88). Мыла и детергенты. Омыление жиров с помощью гидроксида натрия или гидроксида калия проводится главным образом при получении мыла. Мыла представляют собой щелочные соли высших жирных кислот: СН2—ОСОС17Н35 СН2ОН | | СН—ОСОС17Н35 + 3NaOH ® СНОН + 3C17H35COONa | | стеарат натрия (мыло) СН2—ОСОС17Н35, СН2ОН
В промышленности в качестве исходных веществ для их получения применяются животные жиры, хлопковое, пальмовое, кокосовое масла, гидрогенизиро- ванные жиры. При нагревании их с гидроксидом натрия образуется густой раствор («мыльный клей»), содержащий глицерин и соли жирных кислот. Затем к еще горячей жидкости прибавляют поваренную соль — «высаливают» натриевое мыло. Все мыла, являясь щелочными солями слабых кислот, в воде частично гидролизуются с образованием свободной жирной кислоты и гидроксида щелочного металла, поэтому их растворы имеют щелочную реакцию: C17H35COONa + Н20 ®С17Н35С00Н + NaOH. При добавлении натриевого мыла к жесткой воде ионы кальция и магния замещают ионы натрия, образуя нерастворимые и поэтому не обладающие моющим действием кальциевые и магниевые мыла. Поэтому моющая способность мыла в жесткой воде значительно снижается. Одним из способов смягчения «жесткой» (содержащей ионы Са2ч~, Mg2+и Fe3+) воды является обработка ее хелатирующими агентами. Чаще всего используют ЭДТА — этилендиаминтетрауксусную кислоту, которая связывает, например, Са2+ в устойчивый растворимый в воде хелат Детергенты В продаже под различными названиями имеются моющие средства (детергенты), заменители мыл, представляющие собой, например, смесь натриевых солей эфиров серной кислоты и высших спиртов (главным образом лаурилового и цетилового): R—S03Na, где R — от С10 до С16. Эти соединения (а также часто применяемые для этих целей алкансульфонаты R—S03Na, где R — от С10 до С1б) можно использовать и в жесткой воде, так как они не образуют нерастворимых соединений с кальцием и магнием; они не обладают сильными щелочными свойствами и поэтому не повреждают тканей. Свойства мыла или детергента заметно изменяются и в зависимости от природы противоположно заряженного иона, свободно перемещающегося в водной среде. Производство детергентов непрерывно растет, а доля мыл в производстве моющих и чистящих средств постоянно сокращается. Это позволит высвободить значительное количество низкокачественных жиров для питания сельскохозяйственных животных. Омыление жиров с помощью гидроксида натрия или гидроксида калия проводится главным образом при получении мыла. Мыла представляют собой щелочные соли высших жирных кислот:
СН2—ОСОС17Н35 СН2ОН | | СН—ОСОС17Н35 + 3NaOH ® СНОН + 3C17H35COONa | | стеарат натрия (мыло) СН2—ОСОС17Н35, СН2ОН
|
||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 896; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.227.134.95 (0.006 с.) |