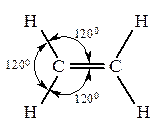Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Алканы. Общая характеристика: строение, изомерия, номенклатура.Содержание книги
Поиск на нашем сайте
Алканы (парафины или предельные углеводороды) – наиболее простой по элементному составу класс органических соединений. Они состоят из углерода и водорода. Родоначальником этого класса является метан СН4. Все остальные углеводороды, относящиеся к алканам, являются членами гомологического ряда метана. Общая формула алканов СnН2n+2 Углерод имеет на внешней оболочке четыре валентных электрона, поэтому он может образовывать с атомами водорода четыре двухэлектронные ковалентные связи:
При переходе к высшим гомологам число изомеров резко возрастает (смотри выше). Углеродный атом, связанный с одним соседним углеродным атомом, называется первичным, с двумя – вторичным, с тремя – третичным и с четырьмя – четвертичным:
Для названий алканов может использоваться несколько номенклатур: историческая, или тривиальная номенклатура – это сводка исторически устоявшихся названий часто употребимых органических соединений. – рациональная номенклатура. При составлении названия по этой номенклатуре соединение рассматривается как полученное из самого простого представителя ряда в результате замещения в нем водородных атомов на алкильные радикалы.
Гомологический ряд, последовательность органических соединений с одинаковыми функциональными группами и однотипным строением, каждый член которой отличается от соседнего на постоянную структурную единицу (гомологическую разность), чаще всего метиленовую группу —СН2—. Члены гомологического ряда называют гомологами. В гомологических рядах многие физические свойства закономерно изменяются. Например, температуры кипения в середине ряда соединений с неразветвленной цепью (С5-С14) различаются у соседних гомологов на 20-30°С; гомологической разности —СН2—соответствует возрастание теплоты сгорания на 630-640 кДж/моль и молекулярной рефракции на 4,6 для D-линии натрия. У высших членов гомологического ряда эти различия постепенно сглаживаются.
Физические и химические свойства алканов. Методы получения и идентификации алканов. Отдельные представители. Физические свойства алканов. Первые четыре члена ряда – метан, этан, пропан и бутан – при комнатных условиях газы. Алканы С5–С15 – жидкие, а С16 и далее – твердые.
В обычных условиях Химические свойства алканов Углеводороды ряда метана при обыкновенной температуре химически весьма инертны. Они не присоединяют водород (отсюда – предельные), не реагируют без инициирования с Cl2 и Br2, не окисляются на холоду такими сильными окислителями, как перманганат калия и хромовая кислота В то же время эти связи сравнительно легко подвергаются гомолитическому разрыву с образованием радикалов. Поэтому для алканов в большей мере свойственны реакции радикального замещения. – Галоидирование На свету алканы могут последовательно замещать атомы водорода на атомы галоида, например: При температуре» 500 °С метан под воздействием азотной кислоты и двуокиси азота нитруется: – Сульфирование Серная кислота (олеум) при нагревании медленно сульфирует алканы с третичным атомом углерода: – Сульфохлорирование Под действием ультрафиолетового освещения алканы вступают в реакцию замещения со смесью SO2 + Cl2: – Окисление У изоалканов сравнительно легко окисляется третичная группа СН. Промышленный интерес представляет каталитическое окисление смеси высших предельных углеводородов С8 – С18:
– Дегидрирование При t = 300 °C…400 °С алканы, пропущенные над катализатором теряют два атома водорода и превращаются в алкены:
– Изомеризация Под действием кислых катализаторов (например, AlCl3, H2SO4 и др.) алканы способны к перестройке углеродного скелета:
Способы получения алканов – Гидрирование ненасыщенных углеводородов – Из галоидных алкилов ( реакция Вюрца, 1870 г.) – Из карбоновых кислот – Крекинг и пиролиз алканов нефти:
5. Алкены. Общая характеристика: строение, изомерия, номенклатура.
Гомологический ряд алкенов начинается с этилена. Алкены (олефины, этиленовые углеводороды)– углеводороды, которые содержат в молекуле одну двойную связь. Общая формула – CnH2n.
Изомерия. Номенклатура Как и в ряду предельных углеводородов структурная изомерия алкенов начинается с четвертого члена ряда. Однако число изомеров значительно больше. Изомерия олефинов обусловлена строением углеродной цепи, во-вторых – положением двойной связи в цепи и в-третьих – пространственным расположением атомов или групп при углеродах с двойной связью
Называют алкены по различным номенклатурам. В тривиальной номенклатуре к названию соответствующего радикала предельного углеводорода добавляют суффикс –ен: этилен, пропилен, бутилен, изобутилен, амилен и т.д. По рациональной номенклатуре олефины называются как производные этилена. При составлении названия по номенклатуре ИЮПАК в качестве основной цепи соединения выбирается самая длинная углеродная цепочка, включающая двойную связь. За основу названия берется название алкана с заменой окончания -ан на Например: СН2=СН2 этилен; этен
|
||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 6130; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.79.214 (0.007 с.) |

 или
или 

 – номенклатура IUPAC
– номенклатура IUPAC