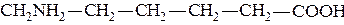Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Физические и химические свойства аминокислот. Метод получения.Содержание книги
Поиск на нашем сайте
Методы получения. – Аминокислоты имеют чрезвычайно большое физиологическое значение. Из остатков аминокислот построены белки и полипептиды. При гидролизе белковых веществ животных и растительных организмов образуются аминокислоты. – Действие аммиака на галоидзамещённые кислоты
– α-Аминокислоты получают действием аммиака на оксинит-рилы
Оксинитрилы получают действием на альдегиды HCN
Физические свойства. Аминокислоты в настоящее время рассматриваются как продукты нейтрализации карбоксила и аминогруппы в одной и той же молекуле, т.е. как внутренние соли
Химические свойства. Поскольку в молекулах аминокислот имеются амино- и карбоксильные группы, они вступают в реакции, характерные для этих функциональных групп. Эти реакции были рассмотрены ранее в соответствующих разделах курса. Дополнительно к этому познакомимся со свойствами аминокислот, которые обусловлены одновременным присутствием в структуре молекул обеих функциональных групп. – Наличие в молекуле аминокислоты кислотной и основной групп обуславливает амфотерность этих соединений и существование их в виде биполярного иона. В кислой среде образуется катион соли аминокислоты как основания, в щелочной – анион соли аминокислоты, как кислоты.
Концентрация водородных ионов (рН среды), при которой амфотерное соединение наименее и в равной мере диссоциировано по обоим направлениям, называется изоэлектрической точкой. Изоэлектрическая точка для каждой аминокислоты является индивидуальной характеристикой и может использоваться для их идентификации. – С основаниями аминокислоты образуют соли. Особенно характерно образование медных солей, имеющих интенсивную синюю окраску. Эти вещества являются внутрикомплексными соединениями
– Химическое поведение аминокислот в значительной мере определяется взаимным расположением аминогруппы и карбоксила. Особенно ярко это проявляется при нагревании аминокислот. α-Аминокислоты при нагревании легко отщепляют воду и дают дикетопиперазины.
Отдельные представители. α-Аминопропионовая кислота (α-аланин)
В α-аланине имеется асимметрический атом углерода. Поэтому он оптически активен. L(+)-аланин входит в состав всех белков. Его можно получать гидролизом фиброина шёлка. 2,6-диаминогексановая кислота (лизин)
В состав лизина входят две аминогруппы и один карбоксил. Поэтому он является сильным основанием. L(+)-лизин входит в состав белков и относится к незаменимым аминокислотам. 6-Аминогексановая кислота (ε-аминокапроновая)
Эта кислота и её лактам, капролактам, используется для получения синтетического волокна капрон.
25. Белки. Классификация белков. Функции белков. Источники получения белков. Белки в зависимости от химического строения делят на простые и сложные. Простые белки при гидролизе распадаются только на аминокислоты. При гидролизе сложных белков наряду с аминокислотами образуется вещество небелковой природы – простетическая группа. Классификация простых белков основана на их растворимости. Альбумины – водорастворимые белки с высокой гидрофильностью, выпадают в осадок при 100%-ом насыщении сульфатом аммония. К этим белкам относятся белок куриного яйца, белки зародыша семян злаковых и бобовых культур. Альбумин пшеницы называют лейкозин, гороха – легумелин. Альбумины содержат все незаменимые аминокислоты. Глобулины – растворяются в солевых растворах, чаще всего для извлечения глобулинов используют 2 –10%-ый раствор хлорида натрия. Они осаждаются 50%-ым раствором сульфата аммония. Белки семян бобовых и масличных культур в основном представлены глобулинами; легумин – гороха и чечевицы, фазеолин – фасоли; глицин – соевых бобов. Многие альбумины и глобулины обладают ферментативным действием. Биологическая роль белков 1. Ферментативная (каталитическая). В биологических системах почти все реакции катализируются специфическими белками – ферментами. 2. Строительная, структурная функция. Белки образуют основу протоплазмы любой живой клетки, в комплексе с липидами они являются основным структурным материалом всех клеточных мембран всех органелл. 3. Двигательная функция. Любые формы движения в живой природе (работа мышц, движение ресничек и жгутиков у простейших, движение протоплазмы в клетке и т.д.) осуществляется белковыми структурами. 4. Транспортная функция. Перенос различных молекул, ионов осуществляется специфическими белками. 5. Регуляторная функция. Регуляция углеводного, белкового, липидного обменов осуществляется с помощью гормонов, которые по своему строению относятся к белкам (инсулин) или пептидам (окситоцин, вазопрессин и др.). 6. Защитная – эту функцию выполняют иммуноглобулины (антитела). Они обладают способностью обезвреживать бактерии, вирусы, чужеродные белки, попавшие в организм извне. 7. Фоторецепторные белки: например, родопсин, участвующий в зрительных процессах. 8. Резервные белки используются, как запасной материал для питания развивающегося зародыша и новорожденного организма – это белки семян зернобобовых культур, альбумин – яичный белок, казеин молока. Ферретин – белок животных тканей в котором запасено железо. Резервные белки являются важнейшими компонентами растительной и животной пищи. Основными источниками незаменимых аминокислот являются белки животного происхождения (молоко, творог, мясо, яйца, рыба). В продуктах растительного происхождения (мука, крупы, бобовые) белки не содержат полного набора незаменимых аминокислот или содержат их в недостаточном количестве. Вместе с тем, растительные белки обладают низкой усвояемостью (60% против 90% у животных белков).
|
||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 674; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.136.22.204 (0.007 с.) |