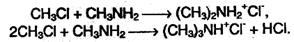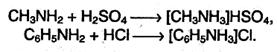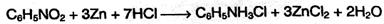Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Предельные алифатические аминыСодержание книги
Поиск на нашем сайте
Номенклатура и изомерия Общая формула предельных алифатических аминов CnH2n+3N. Названия аминов обычно производят, перечисляя углеводородные радикалы (в алфавитном порядке) и добавляя окончание - амин, например:
По другой системе названия первичных аминов строят, исходя из названия родоначального углеводорода и добавляя окончание - амин с указанием номера атома углерода, связанного с аминогруппой. Атом азота в молекулах аминов находится в состоянии sp3-гибридизации. Три из четырех гибридных орбиталей участвуют в образовании σ-связей N–C и N-H, на четвертой орбитали находится неподеленная электронная пара, которая обусловливает основные свойства аминов:
Электронодонорные заместители (предельные углеводородные радикалы) увеличивают электронную плотность на атоме азота и усиливают основные свойства аминов, поэтому вторичные амины – более сильные основания, чем первичные, поскольку два радикала создают на атоме азота большую электронную плотность, чем один.
Изомерияаминов связана со строением углеродного скелета и положением аминогруппы:
Кроме того, первичные, вторичные и третичные амины, содержащие одинаковое число атомов углерода, изомерны между собой, например:
Физические свойства Метиламин, диметиламин и триметиламин – газы, средние члены алифатического ряда – жидкости, высшие – твердые вещества. Между молекулами аминов в жидкой фазе образуются слабые водородные связи, поэтому температуры кипения аминов выше, чем у соответствующих углеводородов. Амины также образуют слабые водородные связи с водой, поэтому низшие амины хорошо растворимы в воде, по мере роста углеродного скелета растворимость в воде уменьшается. Низшие амины имеют характерный «рыбный» запах, высшие не имеют запаха. Получение 1. Основной способ получения аминов – алкилирование аммиака, которое происходит при нагревании алкилгалогенидов с аммиаком:
При избытке алкилгалогенида полученный первичный амин также может вступать в реакцию алкилирования, превращаясь во вторичный или третичный амин, например:
Практически в таких реакциях получается смесь солей первичного, вторичного и третичного аминов, из которой амины выделяют под действием щелочи и разделяют путем перегонки. 2. Первичные амины также получают восстановлением нитросоединений по схеме:
Для восстановления используют сульфид аммония (реакция Зинина ), цинк или железо в кислой среде, алюминий в щелочной среде или непосредственно водород в газовой фазе. 3. Первичные амины можно получать восстановлением нитрилов:
В качестве восстановителя используют алюмогидрид лития LiAlH4. 4. В биологических системах может происходить ферментативное декарбоксилирование аминокислот:
Химические свойства 1. Благодаря наличию электронной пары на атоме азота, все амины обладают основными свойствами, причем алифатические амины являются более сильными основаниями, чем аммиак. Водные растворы аминов имеют щелочную реакцию:
Амины в чистом виде или в растворах взаимодействуют с кислотами, образуя соли, которые являются аналогами солей аммония:
Соли аминов – твердые вещества, хорошо растворимые в воде и плохо растворимые в неполярных органических растворителях. Щелочи превращают соли аминов в свободные амины подобно тому, как из солей аммония щелочи вытесняют аммиак.
2. Амины – органические аналоги аммиака, поэтому они могут образовывать комплексные соединения с переходными металлами:
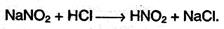
Неподеленная пара электронов амина в этих комплексах занимает свободную орбиталь во внешнем слое центрального атома, образуя донорно-акцепторную связь. 3. Первичные и вторичные амины реагируют с азотистой кислотой, образующейся при добавлении нитрита натрия к разбавленной соляной кислоте:
Первичные амины под действием азотистой кислоты превращаются в спирты:
Промежуточным соединением в этой реакции является неустойчивый ион диазония [R-N ≡ N]+. Вторичные амины с азотистой кислотой дают N-нитрозамины – маслянистые жидкости с характерным запахом:
Третичные алифатические амины с азотистой кислотой не реагируют. Таким образом, азотистая кислота – реагент, позволяющий определять тип амина. 4. При сгорании аминов образуются углекислый газ, азот и вода:
Применение Низшие алифатические амины используются для синтеза лекарственных средств, пестицидов и пластмасс. Ароматические амины Анилин (фениламин) C6H5NH2 – родоначальник класса ароматических аминов, в которых аминогруппа непосредственно связана с бензольным кольцом. Эта связь приводит к важным последствиям. Неподеленная электронная пара атома азота взаимодействует с π-электронной системой бензольного кольца. Данное взаимодействие можно описать следующими предельными (или резонансными) структурами:
Молекула анилина представляет собой среднее между изображенными четырьмя структурами. Эти структурные формулы показывают, что электронная пара азота втягивается в бензольное кольцо, при этом на атоме азота появляется частичный положительный заряд, и основные свойства аминогруппы уменьшаются. В бензольном кольце, напротив, электронная плотность увеличивается, причем наиболее сильно – в положениях 2, 4 и 6 (орто- и пара-) по отношению к аминогруппе. Приведенные выше структурные формулы можно объединить в одну, в которой смещение электронной плотности (+M-эффект группы NH2) изображено стрелками:
Физические свойства Анилин – бесцветная маслянистая жидкость, немного тяжелее воды, мало растворима в воде, растворима в этиловом спирте и в бензоле. Основной способ получения анилина – восстановление нитробензола. В промышленных условиях восстановление проводят водородом при 250-350°С на никелевом или медном катализаторе:
В лаборатории для этой цели используют цинк в кислой среде:
или алюминий в щелочной среде:
В последних двух реакциях реальный восстановитель – водород в момент выделения. Химические свойства 1. Анилин – гораздо более слабое основание, чем алифатические амины (Кb = 5,2-10-10). Это объясняется тем, что электронная пара атома азота, которая обусловливает основные свойства аминов, частично смещается в бензольное кольцо. Анилин реагирует с сильными кислотами, образуя соли фениламмония С6Н5NН3+, которые растворимы в воде, но нерастворимы в неполярных органических растворителях:
2. Анилин весьма активен в реакциях электрофильного замещения в бензольном кольце. Это объясняется электронными эффектами, которые приводят к увеличению электронной плотности в кольце. Анилин легко бромируетея даже под действием бромной воды, давая белый осадок 2,4,6-триброманилина:
С концентрированной азотной кислотой анилин реагирует со взрывом, поэтому непосредственное нитрование осуществить не удается. Можно, однако, на время реакции защитить аминогруппу, если перед нитрованием превратить ее в амидную группу –NH-CO-СН3 действием уксусного ангидрида (СН3СО)О, а после нитрования гидролизовать амид с образованием исходной аминогруппы. Данная последовательность реакций описывается схемой:
В этих реакциях образуется также небольшое количество орто- нитроанилина. 3. При реакции анилина с азотистой кислотой образуются диазо-соединения – соли диазония C6H5N2+:
Диазосоединения можно выделить в виде кристаллических, легко взрывающихся веществ. Благодаря способности диазониевой группы легко замещаться на другие функциональные группы, эти соединения широко используются в органических синтезах. Во многих случаях можно не выделять диазосоединения в кристаллическом виде, а использовать их свежеприготовленные растворы. 4. Анилин легко окисляется различными окислителями с образованием ряда соединений, поэтому он темнеет при хранении. При действии хлорной извести Са(Сl)ОСl на водный раствор анилина появляется интенсивное фиолетовое окрашивание. Это – качественная реакция на анилин. Применение Основная область применения анилина – синтез красителей и лекарственных средств. В качестве примера приведем схему синтеза красителя метилового оранжевого (кислотно-основного индикатора):
|
||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 496; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.222.132 (0.009 с.) |



 В третичных аминах важную роль играет пространственный фактор: три радикала загораживают электронную пару атома азота и затрудняют ее взаимодействие с другими молекулами, поэтому основность третичных аминов меньше, чем первичных или вторичных.
В третичных аминах важную роль играет пространственный фактор: три радикала загораживают электронную пару атома азота и затрудняют ее взаимодействие с другими молекулами, поэтому основность третичных аминов меньше, чем первичных или вторичных.