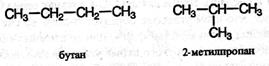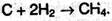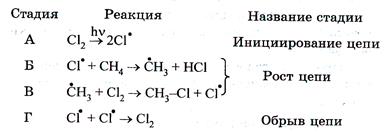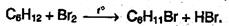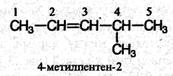Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Промышленное производство органических соединенийСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Возрастающая роль органических соединений в современном мире вызывает потребность в создании промышленного производства, способного производить их в достаточном количестве. Для такого производства необходимы доступные, дешевые и широко распространенные в природе источники сырья, из которою можно было бы получать необходимые соединения. Выяснилось, что этим требованиям удовлетворяют три ископаемых источника сырья, а именно: каменный уголь, природный газ и нефть. Первое сырье для производства органических материалов было получено сухой перегонкой (карбонизацией, пиролизом) каменного угля, т.е. нагреванием угля без доступа воздуха. Продуктами такой сухой перегонки являются в основном ароматические углеводороды и их производные; из них получали, прежде всего, синтетические красители, и производство красителей стало первой большой отраслью промышленности органических материалов. Постепенно развивались и другие важные отрасли, как, например, промышленное сбраживание, переработка растительных и животных жиров и масел и т.д. Но с течением времени постоянно возрастало значение природного газа и нефти как источников химического сырья. Поэтому все шире разрабатывались и усовершенствовались соответствующие химические процессы. В настоящее время из природного газа и нефти получают свыше 90% всех синтезируемых органических соединений. Лабораторные и промышленные способы получения. Между лабораторным и промышленным синтезом органических соединений имеется ряд принципиальных различий. Например, цена химикатов, использованных в лабораторном синтезе, обычно не имеет решающе го значения, поскольку синтез проводится в сравнительно малых масштабах. Поэтому при лабораторном восстановлении кетонов в спирты можно использовать дорогой алюмогидрид лития, в то время как в промышленности для этих целей применяют дешевые водород и никелевый катализатор. Другим примером дешевого реагента является кислород воздуха, с помощью которого в промышленности осуществляется ряд процессов каталитического окисления. Исходный материал для промышленных синтезов также должен быть дешевым и легкодоступным в больших количествах. Поэтому такой материал в большинстве случаев получают с помощью простейших методов из указанных выше источников сырья, прежде всего из природного газа и нефти. Применяемые растворители тоже должны быть дешевыми, а кроме того (по возможности) негорючими. Другая проблема – работа с ядовитыми веществами. В лабораторном синтезе обычно можно использовать ядовитые соединения, работая в вытяжном шкафу или, в крайнем случае, в маске. Применение таких соединений в промышленном производстве крайне нежелательно, поскольку существует постоянно угроза утечки их в воздух или попадания в сточные воды. В промышленности работают по возможности при нормальных или умеренно повышенных температурах, так как подвод тепла в больших количествах дорог. С другой стороны, в промышленности, вообще говоря, проще применять высокие температуры. Другое важное различие заключается в том, что в лаборатории чаще всего работают с чистыми веществами, а на производстве обычно имеют дело со смесями. Аналогично при лабораторных синтезах стремятся получить чистый продукт, а в промышленных синтезах иногда удовлетворяются смесями, которые часто находят выгодное непосредственное применение (например, бензин). Если нужно разделить такие смеси, то используют всевозможные непрерывные процессы, которые хотя и требуют много времени (и поэтому обычно совершенно непригодны для применения в лаборатории), но зато эффективны. Другое большое достоинство промышленных процессов заключается в том, что при малом выходе продуктов можно организовать циклическое введение в процесс непрореагировавших исходных веществ и достичь, таким образом, практически полной их переработки. Такой процесс очень экономичен, но в лабораторных условиях осуществляется с большим трудом. Из всех приведенных выше доводов ясно, что многие реакции, которые успешно протекают в лаборатории, практически неприменимы в химической промышленности и наоборот.
CH4 + H2O → 3H2 + CO (700-900°C, Ni) Газ аналогичного состава можно получить взаимодействием раскаленного кокса с водяным паром, откуда происходит название водяной газ: C + H2O → H2 + CO (1000°C) В частности, именно из оксида углерода (II) и водорода под давлением до 250 атм. в присутствии катализаторов получают метанол CO + 2H2 → CH3OH Природный газ обычно сопровождает залежи нефти, но имеются и самостоятельные месторождения газа. Нефть представляет собой темную, маслянистую, не растворяющуюся в воде жидкость и содержит главным образом неразветвленные и разветвленные алканы, циклоалканы, а иногда и другие углеводороды (примерно до 50 атомов углерода в молекуле). Состав нефти зависит от месторождения. Использование природного газа и нефтепродуктов для получения энергии представляется неэффективным. Энергию можно получать и другим способом (без сжигания углеводородов), а вот подыскать замену природному газу и нефти как источникам химического сырья невозможно (об этом крайне эмоционально говорил еще Д.И. Менделеев!). Хотя происхождение нефти и природного газа еще не выяснено во всех подробностях, бесспорно, что нефть образовалась при разложении растительных и животных остатков (в том числе и морского планктона) в течение долгих геологических периодов. Этот сложный процесс начался свыше миллиарда лет назад и протекал под действием микроорганизмов без доступа воздуха при повышенных температурах и давлениях. Переработка нефти. Дробная перегонка «сырой» нефти приводит к ее разделению на фракции, кипящие в широком температурном интервале, а именно: - углеводородный газ (пропан, бутан) - бензиновая фракция, т.кип. до 200°C - керосин, т.кип. 220-275°C - газойль или дизельное топливо, т.кип. 200-400°C - смазочные масла, т.кип. выше 300°C - остаток (мазут) В состав бензиновой фракции обычно входят петролейный эфир (т.кип. 20-60 °С) и так называемый экстракционный бензин (т.кип. 60-120 °С). Фракция, кипящая при температурах от 40 до 200 °С, называется бензином и относится к наиболее ценным нефтепродуктам, поскольку служит топливом для двигателей внутреннего сгорания. В бензине содержатся преимущественно углеводороды С6-С9. Керосин, содержащий углеводороды C9-C16, применяется в небольших отопительных устройствах, а также служит топливом для турбинных двигателей; пиролизуется (крекинг) до низших углеводородов. Газойль, или дизельное топливо, имеет подобное применение, но главным образом используется как топливо для дизельных двигателей. Смазочные масла (или нефтяные масла), содержащие углеводороды С20-С50, очищаются (рафинируются) и применяются в качестве смазочных материалов. Остаток после перегонки, мазут, используют как топливо или подвергают вакуумной перегонке, в результате которой получают следующую высококипящую углеводородную фракцию. Остатком является асфальт, служащий для покрытия мостовых. Химические превращения углеводородов, содержащихся в нефти. Естественно, что при современном развитии автомобильного и авиационного транспорта потребность в бензине непрерывно возрастает. Поэтому было необходимо найти способы получения бензина из высококипящих фракций нефти. Такой способ найден и назван крекингом. Он заключается в том, что высшие алканы нагреваются до высоких температур без доступа кислорода. При этом происходит их расщепление на низшие алканы и алкены. В качестве примера приведем продукты, которые могут образоваться при крекинге н- гексана:
Если при крекинге не используется катализатор, а только повышенные температуры, то говорят о термическом крекинге. Этот процесс имеет радикальный механизм. Если же используется катализатор, например SiO2 и Аl2О3, то говорят о каталитическом крекинге, который имеет ионный механизм. При крекинге фракций нефти в огромных количествах образуются этен и пропен, поэтому оба этих вещества стали важным сырьем для промышленности органических материалов. Для улучшения качества бензина были разработаны процессы, называемые риформингом или изомеризацией и алкилированием. Основным моторным топливом в наше время является бензин. Прежде чем говорить о его качестве, обратим внимание на процессы, протекающие в цилиндрах бензинового двигателя. В этом двигателе происходит сжигание предварительно сжатой смеси паров бензина и воздуха, подожженной электрической искрой. Смесь быстро сгорает с образованием диоксида углерода и воды, а также меньшего количества продуктов неполного окисления (в том числе оксида углерода (II)). Часть высвобожденной при горении энергии с помощью движения поршня превращается в механическую энергию. Топлива для бензиновых двигателей имеют разные свойства. При использовании некоторых из них мотор работает нормально, а другие приводят к стуку мотора. Это означает, что сгорание протекает слишком быстро, т.е. вместо Спокойного горения произошла детонация и высвобожденная взрывом сила неправильно распределилась в сжатом пространстве Представителем непригодного топлива является гептан СН3(СН2)5СН3, в то время как 2,2,4-триметилпентан (часто называемый изооктаном), напротив, имеет в этом отношении уникальные свойства. Оба этих соединения были взяты за основу шкалы так называемых октановых чисел; гептану было по определению присвоено значение нуль, а «изооктану» – сто. Согласно этой шкале, например, бензин с октановым числом 90 имеет свойства смеси 90% «изооктана» и 10% гептана. Чем больше октановое число топлива, тем выше его качество. Некоторые соединения имеют октановое число больше 100. Бензин, полученный из нефти простой перегонкой, имеет октановое число от 50 до 55 и непригоден для непосредственного использования в двигателях. Бензин более высокого качества получается при крекинге:его октановое число составляет 70-80. Поскольку для современных двигателей требуется топливо с октановым числом более 90, были разработаны методы улучшения бензинов, добываемых так называемым риформингом и алкилированием. Риформинг заключается в изомеризации, при которой неразветвленные или малоразветвленные алканы при нагревании с подходящим катализатором превращаются в более разветвленные алканы с большим октановым числом, чем октановое число исходных алканов. Превращение неразветвленных алканов в разветвленные можно схематически представить следующим образом:
Алкилированием представляет собой ионную реакцию, катализируемую кислотами, при которой происходит объединение низших алканов и алкенов в высшие разветвленные, имеющие октановое число более высокое, чем октановые числа исходных углеводородов:
В течение десятилетий ароматические углеводороды получали сухой перегонкой каменного угля. Однако, вследствие усовершенствования нефтехимических процессов, в настоящее время большинство ароматических углеводородов получается из нефти. Принцип получения ароматических углеводородов из нефти можно схематически представить на примере образования бензола. Гексан каталитически превращается в циклогексан, который дегидрируется в бензол (реакция циклизации с одновременным дегидрированием):
Аналогичным образом получают толуол и ксилолы. В настоящее время из нефти получают более 90% всех органических соединений. В основе этого производства лежит превращение содержащихся в нефти углеводородов в ненасыщенные углеводороды, как, например, в этен, пропен, бутены и арены. Эти реакционно-способные углеводороды служат затем исходными веществами для большинства синтезов других соединений. Очень интересно получение смеси белков, образующейся при превращении некоторых фракций нефти под действием микроорганизмов. Каменный уголь. Каменный уголь – это горючее ископаемое, образовавшееся в доисторическую эпоху в результате сложных процессов из отмерших остатков растений. В нем содержатся как органические, так и неорганические вещества. При сухой перегонке (карбонизации) угля, т.е. при нагревании до высоких температур без доступа воздуха, образуется сложная смесь твердых, жидких и газообразных продуктов. Газофазным продуктом является коксовый газ, содержащий прежде всего метан и водород. Жидким продуктом сухой перегонки является деготь. Из дегтя было выделено более 300 соединений, прежде всего фенол, крезолы, пиридин, нафталин, антрацен, тиофен и циклопентадиен-1,3. Твердый остаток сухой перегонки, кокс, имеет промышленное значение, для производства железа, ацетилена и водяного газа. С учетом быстро возрастающей потребности в органических химикатах их получение из продуктов сухой перегонки каменного угля теряет значение, и преобладает нефтехимическое производство. Так, нафталин, типичный продукт сухой перегонки угля, теперь получается в основном из нефти, Однако процесс сухой перегонки сохраняет свое значение как источник кокса. Ожидается, что в ближайшем будущем значение каменного угля как химического сырья возрастет, потому что его мировые запасы существенно больше, чем запасы нефти. Снова исследуются забытые в течение десятков лет проблемы каталитического гидрирования угля с целью получения топлива для двигателей внутреннего сгорания.
Глава 21. АЛКАНЫ
Номенклатура и изомерия Алканы являются насыщенными, или предельными, углеводородами, поскольку все свободные валентности атомов углерода заняты (полностью «насыщены») атомами водорода. Простейшим представителем алканов служит метан СН4. Начиная с него, можно построить ряд, в котором каждый последующий углеводород отличается от предыдущего на одну группу СН2. Члены этого ряда называются гомологами, а сам ряд – гомологическим. Общая формула гомологического ряда алканов СnН2n+2 По систематической номенклатуре ИЮПАК первым четырем членам гомологического ряда алканов присвоены их исторически сложившиеся названия – метан, этан, пропан, бутан. Названия остальных алканов с нормальной, т.е. неразветвленной углеродной цепью, составляются из греческого названия числительного, соответствующего числу атомов углерода в цепи, с добавлением суффикса -ан.
Алканы с разветвленной цепью рассматриваются как производные нормального алкана, в котором один или несколько атомов водорода замещены на углеводородные радикалы. Для этого выбирают главную углеродную цепь, которая содержит наибольшее число атомов углерода и составляет основу названия. Главную цепь нумеруют с того конца, ближе к которому находится заместитель. Перед основой названия указывают номер атома углерода, при котором находится заместитель, и название этого заместителя, например:
В молекуле метана атом углерода связан с четырьмя атомами водорода (СН4). Электронная формула углерода в основном состоянии 1s22s22р2, а в возбужденном состоянии 1s,22s12рз. Атом углерода в возбужденном состоянии имеет четыре неспаренных электрона и может связаться с четырьмя атомами водорода. Все четыре связи С–Н в метане одинаковы по длине и прочности, что можно объяснить с привлечением гипотезы о гибридизации атомных орбиталей, имеющие форму неправильной восьмерки – sр3-гибридизация.
Строение других алканов подобно метану. Основу молекул алканов составляет углеродный скелет, который может принимать самые разные геометрические формы при сохранении длин связей и углов между связями. Например, углеродная цепь пентана С5Н12 может выглядеть следующим образом:
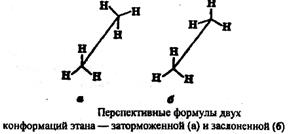
Данные положения углеродной цепи называются конформациями. При обычных температурах разные конформации алканов свободно переходят друг в друга путем вращения С–С связей, поэтому очень часто конформации называют поворотными изомерами. Так, в молекуле этана С2Н6 возможны два основных положения групп CH3 друг относительно друга – «заторможенное» и «заслоненное».
Основной вид изомерии для алканов – изомерия углеродного скелета. Начиная с С4Н10, одной и той же молекулярной формуле отвечают несколько алканов, различающихся строением углеродного скелета (т.е., числом атомов углерода в главной цепи и/или положением заместителей). Число возможных изомеров СnН2n+2 резко увеличивается с ростом п. Для бутана С24Н10 известны два изомера:
для пентана С5Н12 – три, для гексана С6Н14 – 5, для гептана С7Н16 – 9, для октана C8H18 – 18, для нонана С9Н20 – 35, для эйкозана С20Н42 – 366319. Для каждого п существует единственный изомер с неразветвленным углеродным скелетом, он называется нормальным. Если у молекулы алкана отнять один атом водорода, то получаются углеводородные радикалы с одной свободной валентностью. Общая формула предельных углеводородных радикалов CnH2n+1. Названия углеводородных радикалов составляются от названия соответствующего углеводорода с добавлением суффикса -ил. Простейшие радикалы:
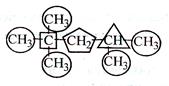
Начиная с С3Н7–, для радикалов возможна структурная изомерия, связанная со строением углеродного скелета или с положением свободной валентности. Так, два радикала С3Н7– (пропил и изопропил) имеют одинаковый углеродный скелет, однако в пропиле свободная валентность находится у первичного атома углерода, а в изопропиле – у вторичного. Атом углерода называют первичным, вторичным, третичным или четвертичным в зависимости от того, с каким числом других углеродных атомов он связан. Например, в молекуле изооктана пять первичных атомов углерода (обведены кружком), один вторичный (обведен пятиугольником), один третичный (в треугольнике) и один четвертичный (показан в квадрате):
Физические свойства В обычных условиях первые четыре члена гомологического ряда алканов (C1 – С4) – газы. Нормальные алканы от пентана до гептадекана (C5 – С17) – жидкости, начиная с C18 и выше – твердые вещества. По мере увеличения числа атомов углерода в цепи, т.е. с ростом относительной молекулярной массы, возрастают температуры кипения и плавления алканов. При одинаковом числе атомов углерода в молекуле алканы с разветвленным строением имеют более низкие температуры кипения, чем нормальные алканы. Алканы практически нерастворимы в воде, так как их молекулы малополярны и не взаимодействуют с молекулами воды, они хорошо растворяются в неполярных органических растворителях, таких как бензол, тетрахлорметан и др. Жидкие алканы легко смешиваются друг с другом. Способы получения Основные природные источники алканов – нефть и природный газ. Различные фракции нефти содержат алканы от C5H12 до С30Н62. Природный газ состоит из метана (95%) с примесью этана и пропана. Из синтетических методов получения алканов можно выделить следующие: 1. Получение из ненасыщенных углеводородов. Взаимодействие алкенов или алкинов с водородом («гидрирование») происходит в присутствии металлических катализаторов (Ni, Pd) при нагревании:
2. Получение из галогенпроизводных. При нагревании моногалогензамещенных алканов с металлическим натрием получают алканы с удвоенным числом атомов углерода (реакция Вюрца ):
Подобную реакцию не проводят с двумя разными галогензамещенными алканами, поскольку при этом получается смесь трех различных алканов. 3. Получение из солей карбоновых кислот. При сплавлении безводных солей карбоновых кислот с щелочами получают алканы, содержащие на один атом углерода меньше по сравнению с углеродной цепью исходных карбоновых кислот (реакция Дюма):
4. Получение метана. В электрической дуге, горящей в атмосфере водорода, образуется значительное количество метана:
Такая же реакция идет при нагревании углерода в атмосфере водорода но 400-500 °С при повышенном давлении в присутствии катализатора. В лабораторных условиях метан можно получить из карбида алюминия:
Химические свойства В обычных условиях алканы химически инертны. Они устойчивы к действию многих реагентов: не взаимодействуют с концентрированными серной и азотной кислотами, с концентрированными и расплавленными щелочами, не окисляются сильными окислителями – перманганатом калия КМnO4 и т.п. Химическая устойчивость алканов объясняется высокой прочностью σ-связей С–С и С–Н, а также их неполярностью. Неполярные связи С–С и С–Н в алканах не склонны к ионному разрыву, но способны расщепляться гомолитически под действием активных свободных радикалов. Поэтому для алканов характерны радикальные реакции, в результате которых получаются соединения, где атомы водорода замещены на другие атомы или группы атомов. Следовательно, алканы вступают в реакции, протекающие по механизму радикального замещения, обозначаемого символом SR (от англ. substitution radicalic). По этому механизму легче всего замещаются атомы водорода у третичных, затем у вторичных и первичных атомов углерода. 1. Галогенирование. При взаимодействии алканов с галогенами (хлором и бромом) под действием УФ-излучения или высокой температуры образуется смесь продуктов от моно- до полигалогензамещенных алканов. Общая схема этой реакции показана на примере метана:
Реакция имеет цепной характер. В цепной реакции выделяют несколько стадий: инициирование (зарождение цепи), рост цепи и обрыв цепи.
Развитие теории цепных свободнорадикальных реакций тесно связано с именем выдающегося русского ученого, лауреата Нобелевской премии Н.Н. Семенова (1896-1986). 2. Нитрование (реакция Коновалова). При действии разбавленной азотной кислоты на алканы при 140 °С и небольшом давлении протекает радикальная реакция:
Как отмечено выше, при радикальных реакциях (галогенирование, нитрование) в первую очередь замещаются атомы водорода у третичных, затем у вторичных и первичных атомов углерода. Это объясняется тем, что легче всего разрывается гомолитически связь третичного атома углерода с водородом (энергия связи 376 кДж/моль), затем – вторичного (390 кДж/моль) и только потом – первичного (415 кДж/моль). 3. Изомеризация. Нормальные алканы при определенных условиях могут превращаться в алканы с разветвленной цепью:
4. Крекинг – это гемолитический разрыв связей С–С, который протекает при нагревании и под действием катализаторов. При крекинге высших алканов образуются алкены и низшие алканы, при крекинге метана и этана образуются ацетилен:
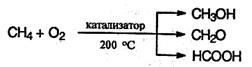
Эти реакции имеют большое промышленное значение. Таким путем высококипящие фракции нефти (мазут) превращают в бензин, керосин и другие ценные продукты. 5. Окисление. При мягком окислении метана кислородом воздуха в присутствии различных катализаторов могут быть получены метиловый спирт, формальдегид, муравьиная кислота:
Мягкое каталитическое окисление бутана кислородом воздуха – один из промышленных способов получения уксусной кислоты:
На воздухе алканы сгорают до СО2 и Н2О:
Применение Промышленное использование алканов подробно рассмотрено выше. Метан, этан, бутан, и другие алканы широко применяются как сырье для промышленных синтезов.
Глава 22. ЦИКЛОАЛКАНЫ
Номенклатура и изомерия Циклоалканы – это предельные циклические углеводороды. Простейшие представители этого ряда:
Общая формула гомологического ряда циклоалканов СnН2n. Точно такой же формулой описывается гомологический ряд алкенов, из чего следует, что каждому циклоалкану изомерен соответствующий алкен – это пример так называемой межклассовой изомерии. Каждый атом углерода в циклоалканах находится в состоянии sр3-гибридизации и образует четыре σ-связи С-С и С-Н. Углы между связями зависят от размера цикла. В простейших циклах С3 и С4 углы между связями С-С сильно отличаются от тетраэдрического угла 109,5°, что создает в молекулах напряжение и обеспечивает их высокую реакционную способность. Свободное вращение вокруг связей С-С, образующих цикл, невозможно. Для циклоалканов, как и для всех классов органических соединений, характерна изомерия углеродного скелета (структурная изомерия). Структурная изомерия для циклоалканов, во-первых, обусловлена размером цикла. Так, существуют два циклоалкана формулы С4Н8: циклобутан и метилциклопропан. Во-вторых, такая изомерия обусловливается положением заместителей в цикле (например, 1,1 и 1,2-диметилбутан). Отсутствие свободного вращения вокруг связей С-С в цикле создает предпосылки для существования пространственных изомеров у некоторых замещенных циклоалканов. Например, в молекуле 1,2-диметилциклопропана две группы СН3 могут находиться по одну сторону от плоскости цикла (цис- изомер) или по разные стороны (транс- изомер):
По размеру цикла циклоалканы делятся на ряд групп, из которых мы рассмотрим малые (С3, С4) и обычные (C5-С7) циклы. Названия циклоалканов строятся путем добавления приставки цикло- к названию алкана с соответствующим числом атомов углерода. Нумерацию в цикле производят таким образом, чтобы заместители получили наименьшие номера. Структурные формулы циклоалканов обычно записывают в сокращенном виде, используя геометрическую форму цикла и опуская символы атомов углерода и водорода.
Физические свойства При обычных условиях первые два члена ряда (С3 - С4) – газы, (C5 – C16) – жидкости, начиная с С17 – твердые вещества. Температуры кипения и плавления циклоалканов выше, чем у соответствующих алканов. Получение 1. Основной способ получения циклоалканов - отщепление двух атомов галогена от дигалогеналканов: 2. При каталитическом гидрировании ароматических углеводородов образуются циклогексан или его производные:
Химические свойства Похимическим свойствам малые и обычные циклы существенно различаются между собою. Циклопропан и циклобутан склонны к реакциям присоединения, т.е. сходны в этом отношении с алкенами. Циклопентан и циклогексан по своему химическому поведению близки к алканам, так как вступают в реакции замещения. 1. Так, например, циклопропан и циклобутан способны присоединять бром (хотя реакция и вдет труднее, чем с прощеном или бутеном):
2. Циклопропан, циклобутан и даже циклопентан могут присоединять водород, давая соответствующие нормальные алканы. Присоединение происходит при нагревании в присутствии никелевого катализатора:
3. В реакцию присоединения с галогеноводородами опять же вступают только малые циклы. Присоединение к гомологам циклопропана происходит по правилу Марковникова:
4. Реакции замещения. Обычные циклы (С6 и выше) устойчивы и вступают только в реакции радикального замещения подобно алканам:
5. Дегидрирование циклогексана в присутствии никелевого катализатора приводит к образованию бензола:
6. При действии сильных окислителей (например, 50%-ной азотной кислоты) на циклогексан в присутствии катализатора образуется адипиновая (гександиовая) кислота:
Глава 23. АЛКЕНЫ (ОЛЕФИНЫ)
Номенклатура и изомерия Алкенами называют непредельные углеводороды, молекулы которых содержат одну двойную связь. Первый представитель этого класса – этилен СН2=СН2, в связи с чем алкены также называют этиленовыми углеводородами. Ближайшие гомологи этилена:
Простейший алкен с разветвленным углеродным скелетом:
Общая формула гомологического ряда алкенов СnН2n. Она совпадает с общей формулой циклоалканов, поэтому алкены и циклоалканы являются межклассовыми изомерами. Валкенах с неразветвленной углеродной цепью нумерацию начинают с того конца, ближе к которому находится двойная связь. В названии соответствующего алкана окончание - ан заменяется на - ен. В разветвленных алкенах выбирают главную цепь так, чтобы она содержала двойную связь, даже если она при этом и не будет самой длинной. Перед названием главной цепи указывают номер атома углерода, при котором находится заместитель, и название этого заместителя. Номер после названия главной цепи указывает положение двойной связи, например:
При отщеплении атома водорода от молекул алкенов образуются непредельные радикалы общей формулы СnН2n-1, простейшие из которых – винил (этенил) и аллил (пропенил):
Атомы углерода при двойной связи находятся в состоянии sp2-гибридизации. Три σ -связи, образованные гибридными орбиталями, располагаются в одной плоскости под углом 120° друг к другу; π-связь образована при перекрывании негибридных 2p-орбиталей соседних атомов углерода. При этом атомные р-орбитали перекрываются не в межъядерном пространстве, а вне его. Такое «боковое» перекрывание менее эффективно, чем осевое, и, следовательно, π- связь является менее прочной, чем σ-связь. Дополнительное π-связывание двух атомов углерода приводит к тому, что уменьшается расстояние между ядрами, поскольку двойная связь является сочетанием σ - и π-связей. Длина двойной связи С=С составляет 0,133 нм, что существенно меньше длины одинарной связи (0,154 нм). Энергия двойной связи (606 кДж/моль) меньше удвоенного значения энергии одинарной связи (347·2 = 694 кДж/моль); это обусловлено меньшей энергией π-связи. Структурная изомерия алкенов обусловлена изомерией углеродного скелета (например, бутен-1 и 2-метилпропен) и изомерией положения двойной связи (бутен-1 и бутен-2). Пространственная, или цис- транс- изомерии обусловлена различным положением заместителей относительно плоскости двойной связи. Этот вид изомерии рассмотрим подробнее. Если каждый из атомов углерода при связи С=С связан с двумя разными заместителями, то эти заместители могут располагаться по одну сторону от плоскости двойной связи (цис-изомер) или по разные стороны (транс -изомер), например:
Эти два изомера нельзя перевести друг в друга без вращения вокруг двойной связи С=С, а это вращение требует разрыва π-связи и затраты большого количества энергии. Поэтому цис- и транс- изомеры представляют собой разные индивидуальные вещества, которые отличаются друг от друга физическими и химическими свойствами. Алкены, у которых хотя бы один из атомов углерода при связи С=С имеет два одинаковых заместителя, не имеют цис- транс- изомеров. Физические свойства Физические свойства алкенов похожи на свойства алканов, хотя все они имеют несколько более низкие температуры плавления и кипения, чем соответствующие алканы. Например, пентан имеет температуру кипения 36 °С, а пентен-1 – 30 °С. При обычных условиях алкены С2 – С4– газы, С5 – С15 – жидкости, начиная с C16 – твердые вещества. Алкены не растворимы в воде, хорошо растворимы в органических растворителях. Получение В природе алкены встречаются редко. Поскольку алкены являются ценным сырьем для промышленного органического синтеза, разработаны многие способы их получения. 1. Основным промышленным источником алкенов служит крекинг алканов, входящих в состав нефти:
Крекинг протекает по свободнорадикальному механизму при 400-700°С. 2. Другой промышленный способ получения алкенов – дегидрирование алканов: | ||||||||||||||||||||||||||||||||||||||
|
| Поделиться: |

 Природный газ и нефть. Природный газ представляет собой смесь газов, состав которой зависит от месторождения. Иногда это почти чистый метан, но обычный состав природного газа таков: около 75% метана, 15% этана и 5% пропана, а также небольшие количества других примесей, прежде всего высших алканов, азота, диоксида углерода, а иногда и гелия. Природный газ используется как промышленное топливо, а содержащиеся в нем алканы, прежде всего метан, являются важным химическим сырьем. Большое значение имеет каталитическое разложение содержащегося в природном газе метана водяным паром при высоких температурах. При этом образуется смесь водорода и оксида углерода, так называемый синтез-газ
Природный газ и нефть. Природный газ представляет собой смесь газов, состав которой зависит от месторождения. Иногда это почти чистый метан, но обычный состав природного газа таков: около 75% метана, 15% этана и 5% пропана, а также небольшие количества других примесей, прежде всего высших алканов, азота, диоксида углерода, а иногда и гелия. Природный газ используется как промышленное топливо, а содержащиеся в нем алканы, прежде всего метан, являются важным химическим сырьем. Большое значение имеет каталитическое разложение содержащегося в природном газе метана водяным паром при высоких температурах. При этом образуется смесь водорода и оксида углерода, так называемый синтез-газ