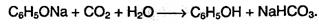Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Глава 27. Гидроксильные соединения (спирты)Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Производные углеводородов, в которых один или несколько атомов водорода замещены на гидроксильную группу –ОН, называют спиртами (алкоголями). В зависимости от характера углеводородного радикала, спирты подразделяют на алифатические, циклические и ароматические, причем у последних гидроксильная группа не связана с атомом углерода бензольного кольца. Соединения, у которых гидроксильная группа связана с бензольным кольцом, называют фенолами. В зависимости от числа гидроксильных групп, спирты подразделяют на одно-, двух- и трехатомные. Двухатомные спирты с гидроксильными группами у соседних атомов углерода называют гликолями. Спирты, содержащие несколько групп –ОН, объединяют общим названием многоатомные спирты. Одноатомные спирты (алкоголи) Номенклатура и изомерия Общая формула гомологического ряда предельных одноатомных спиртов – CnH2n+1OH. В зависимости от того, при каком углеродном атоме находится гидроксильная группа, различают спирты первичные (RCH2-OH), вторичные (R2CH-OH) и третичные (R3C-OH). Названия спиртов образуют, добавляя окончание - ол к названию углеводорода с самой длинной углеродной цепью, включающей гидроксильную группу. Нумерацию цепи начинают с того края, ближе к которому расположена гидроксильная группа. Кроме того, широко распространена радикально-функциональная номенклатура, по которой название спирта производится от соответствующего углеводородного радикала с добавлением слова «спирт», например: С2Н5ОН – этиловый спирт. Простейшие спирты:
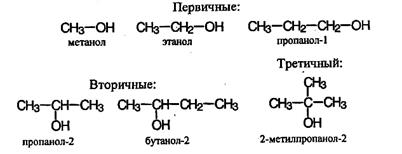
Изомерияодноатомных спиртов связана со строением углеродного скелета (например, бутанол-2 и2-метилпропанол-2) и с положением группы ОН (пропанол-1 и пропанол-2).
Физические свойства Низшие спирты (до C15) – жидкости, высшие – твердые вещества. Метанол, этанол и пропанол-2 смешиваются с водой в любых соотношениях. С ростом молекулярной массы растворимость спиртов в воде падает. По сравнению с соответствующими углеводородами, спирты имеют высокие температуры плавления и кипения, что объясняется сильной ассоциацией молекул спирта в жидком состоянии за счет образования водородных связей. Получение 1. Общий способ получения спиртов, имеющий промышленное значение, – гидратация алкенов. Реакция идет при пропускании алкена с парами воды над фосфорнокислым катализатором (H3PO4): CH2=CH2 + H2O → CH3–CH2–OH Из этилена получается этиловый спирт, из пропена – изопропиловый. Присоединение воды идет по правилу Марковникова, поэтому из первичных спиртов по данной реакции можно получить только этиловый спирт. 2. Другой общий способ получения спиртов – гидролиз алкилгалогенидов под действием водных растворов щелочей: R–Br + NaOH → R–OH + NaBr По этой реакции можно получать первичные, вторичные и третичные спирты. 3. Восстановление карбонильных соединений. При восстановлении альдегидов образуются первичные спирты, при восстановлении кетонов – вторичные:
Реакцию проводят, пропуская смесь паров альдегида или кетона и водорода над никелевым катализатором. 4. Действие реактивов Гриньяра (RMgX) на карбонильные соединения. Взаимодействием реактива Гриньяра с формальдегидом можно получить практически любой первичный спирт (кроме метанола). Для этого продукт присоединения реактива Гриньяра гидролизуют водой:
5. Этанол получают при спиртовом брожении глюкозы. C6H12O6 → 2C2H5H + 2CO2↑ Химические свойства Химические свойства спиртов определяются присутствием в их молекулах группы -ОН. Связи С–О и О–Н сильно полярны и способны к разрыву. Различают два основных типа реакций спиртов с участием функциональной группы -ОН: 1) Реакции с разрывом связи О–Н: а) взаимодействие спиртов с щелочными и щелочноземельными металлами с образованием алкоголятов; б) реакции спиртов с органическими и минеральными кислотами с образованием сложных эфиров; в) окисление спиртов под действием дихромата или перманганата калия до карбонильных соединений. Скорость реакций, при которых разрывается связь О–Н, уменьшается в ряду: первичные спирты > вторичные > третичные. 2) Реакции, сопровождающиеся разрывом связи С–О: а) каталитическая дегидратация с образованием алкенов (внутримолекулярная дегидратация) или простых эфиров (межмолекулярная дегидратация); б) замещение группы –ОН галогеном, например при действии галогеноводородов с образованием алкилгалогенидов. Скорость реакций, при которых разрывается связь С–О, уменьшается в ряду: третичные спирты > вторичные > первичные. Спирты – амфотерные соединения. Реакции с разрывом связи О–Н. 1. Кислотные свойства спиртов выражены очень слабо. Низшие спирты бурно реагируют со щелочными металлами:
но не реагируют со щелочами. С увеличением длины углеводородного радикала скорость этой реакции замедляется. В присутствии следов влаги соли спиртов (алкоголяты) гидролизуются до исходных спиртов:
Это доказывает, что спирты – более слабые кислоты, чем вода. 2. При действии на спирты минеральных и органических кислот образуются сложные эфиры. Образование сложных эфиров протекает по механизму нуклеофильного присоединения-отщепления:
Отличительной особенностью первой из этих реакций является то, что атом водорода отщепляется от спирта, а группа ОН – от кислоты. 3) Спирты окисляются под действием дихромата или перманганата калия до карбонильных соединений. Первичные спирты окисляются в альдегиды, которые, в свою очередь, могут окисляться в карбоновые кислоты:
Вторичные спирты окисляются в кетоны:
Третичные спирты могут окисляться только с разрывом С–С связей. Реакции с разрывом связи С–О. 1) Реакции дегидратации протекают при нагревании спиртов с водоотнимающими веществами. При сильном нагревании происходит внутримолекулярная дегидратация с образованием алкенов:
При более слабом нагревании происходит межмолекулярная дегидратация с образованием простых эфиров:
2) Спирты обратимо реагируют с галогеноводородными кислотами по механизму нуклеофильного замещения SN:
Третичные спирты реагируют быстро, вторичные и первичные – медленно. Применение Спирты главным образом используют в промышленности органического синтеза. Метиловый спирт СН3ОН – ядовитая жидкость температурой кипения 65°С, легко смешивается с водой. Главное промышленное применение метанола – получение формальдегида, метанол используется также качестве растворителя органических веществ. Токсичен в любых дозах, в малых количествах вызывает слепоту, больших – смерть. Этиловый спирт С2Н5ОН – бесцветная жидкость температурой кипения 78°С, смешивается с водой в любых соотношениях. Этанол относится к числу наиболее важных технических продуктов. 80% вырабатываемого спирта используется на технические нужды. Этанол является исходным веществом для получения многих органически соединений, используется в качестве растворителя, как дезинфицирующее средство в медицине, для изготовления лекарственных препаратов и парфюмерно-косметических средств. Предназначенный для технических целей спирт денатурируют – делают непригодным для питья, добавляв к нему метиловый спирт, формалин, пиридин. Такой спирт особенно ядовит. Высшие жирные спирты (ВЖС) содержат более десяти углеродных атомов. Сырье для их получения поставляет нефтехимическая промышленность. Мировое производство ВЖС составляет около 1 млн. т в год. Применяются ВЖС в качестве поверхностно-активных веществ (ПАВ) – антииспарителей (защита водоемов), пенообразователей (флотация руд), для получения синтетических моющих средств, которые полностью разрушаются при биохимической очистке сточных вод и потому не загрязняют водоемы. Цетиловый спирт С16Н33ОН и мирициловый спирт С30Н61ОН встречаются в природе. Первый из них в виде сложного эфира пальмитиновой кислоты составляет главную часть спермацета, добываемого из черепных полостей китов. Мирициловый спирт в виде эфира пальмитиновой кислоты входит в состав пчелиного воска.
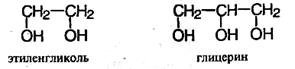
Многоатомные спирты Важнейшие из многоатомных спиртов – этиленгликоль и глицерин:
Это – вязкие жидкости, сладкие на вкус, хорошо растворимые в воде и плохо растворимые в органических растворителях.
Получение 1. Гидролиз алкилгалогенидов (аналогично одноатомным спиртам):
2. Этиленгликоль образуется при окислении этилена водным раствором перманганата калия:
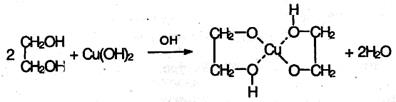
3. Глицерин образуется при гидролизе жиров. Химические свойства Для двух- и трехатомных спиртов характерны основные реакции одноатомных спиртов. В реакциях могут участвовать одна или две гидроксильные группы. Взаимное влияние гидроксильных групп проявляется в том, что многоатомные спирты – более сильные кислоты, чем одноатомные спирты. Поэтому многоатомные спирты, в отличие от одноатомных, реагируют со щелочами, образуя соли. По аналогии с алкоголятями соли двухатомных спиртов называют гликолятами, а трехатомных – глицератами. Качественной реакцией на многоатомные спирты, содержащие группы ОН при соседних атомах углерода, является ярко-синее окрашивание при действии свежеосажденного гидроксида меди (II). Цвет раствора обусловлен образованием комплексного гликолята меди:
Для многоатомных спиртов характерно образование сложных эфиров. В частности, при реакции глицерина с азотной кислотой в присутствии серной кислоты образуется тринитрат глицерина, известный под названием нитроглицерин (последнее название неверно с химической точки зрения, поскольку в нитросоединениях группа -NО2 непосредственно связана с атомом углерода):
Применение Этиленгликоль применяют для синтеза полимерных материалов и в качестве антифриза. В больших количествах его используют также для получения диоксана, важного (хотя и токсичного) лабораторного растворителя. Диоксан получают межмолекулярной дегидратацией этиленгликоля:
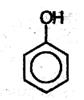
Глицерин находит широкое применение в косметике, пищевой промышленности, фармации, производстве взрывчатых веществ. Чистый нитроглицерин взрывается даже при слабом ударе; он служит сырьем для получения бездымных порохов и динамита – взрывчатого вещества, которое в отличие от нитроглицерина можно безопасно бросать. Динамит был изобретен А. Нобелем, имя которого носит известная всему миру премия за выдающиеся научные достижения в области физики, химии, медицины и экономики. Нитроглицерин токсичен, но в малых количествах служит лекарством, так как расширяет сердечные сосуды и тем самым улучшает кровоснабжение сердечной мышцы. Фенолы Фенолами называют производные ароматических углеводородов, молекулы которых содержат одну или несколько гидроксильных групп, непосредственно соединенных с бензольным кольцом.
Простейший представитель этого класса – собственно фенол, С6Н5ОН. Одна из двух неподеленных электронных пар атома кислорода втягивается в π-электронную систему бензольного кольца (+М-эффект группы ОН). Это приводит к двум эффектам: а) увеличивается электронная плотность в бензольном кольце, причем максимумы электронной плотности находятся в орто- и пара- положениях по отношению к группе ОН; б) электронная плотность на атоме кислорода, напротив, уменьшается, что приводит к ослаблению связи О-Н. Первый эффект проявляется в высокой активности фенола в реакциях электрофильного замещения, а второй – в повышенной кислотности фенола по сравнению с предельными спиртами. Монозамещенные производные фенола, например метилфенол (крезол), могут существовать в виде трех структурных изомеров: орто-, мета- и пара -крезолов:
Физические свойства Фенолы в большинстве своем – кристаллические вещества (мета- крезол– жидкость) при комнатной температуре. Они обладают характерным запахом, довольно плохо растворимы в холодной воде, но хорошо в горячей и особенно в водных растворах щелочей. Фенолы образуют прочные водородные связи и имеют довольно высокие температуры кипения и плавления. Так, собственно фенол представляет собой бесцветные кристаллы с tпл = 41 °С и tкип = 182 °С. С течением времени кристаллы краснеют и темнеют. Способы получения 1. Получение из галогенбензолов. При нагревании хлорбензола и гидроксида натрия под давлением получают фенолят натрия, при дальнейшей обработке которого кислотой образуется фенол:
2. При каталитическом окислении изопропилбензола (кумола) кислородом воздуха образуются фенол и ацетон:
Это – основной промышленный способ получения фенола. 3. Получение из ароматических сульфокислот. Реакцию проводят при сплавлении сульфокислот со щелочами. Первоначально образующиеся феноляты обрабатывают сильными кислотами для получения свободных фенолов. Метод обычно применяют для получения многоатомных фенолов:
Химические свойства В фенолах p-орбиталь атома кислорода образует с ароматическим кольцом единую π-систему. Вследствие такого взаимодействия электронная плотность у атома кислорода уменьшается, а в бензольном кольце повышается. Полярность связи О–Н увеличивается, водород ОН–группы становится более реакционноспособным и легко замещается на металл даже при действии щелочей (в отличие от предельных одноатомных спиртов). 1. Кислотность фенола существенно выше, чем у предельных спиртов; он реагирует как со щелочными металлами:
так и с их гидроксидами (отсюда старинное название «карболовая кислота»):
Кислотные свойства фенолов ослабляются при введении в кольцо заместителей I рода и усиливаются при введении заместителей II рода. 2. Образование сложных эфиров. В отличие от спиртов, фенолы не образуют сложных эфиров при действии на них карбоновых кислот; для этого используют хлорангидриды кислот:
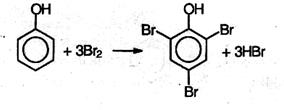
3. Реакции электрофильного замещения в феноле протекают значительно легче, чем в ароматических углеводородах. Поскольку ОН группа является ориентантом I рода, то в молекуле фенола увеличивается реакционная способность бензольного кольца в орто- и пара -положениях (при галогенировании, нитровании, поликонденсации и т.д.). Так, при действии бромной воды на фенол три атома водорода замещаются на бром, и образуется осадок 2,4,6-трибромфенола:
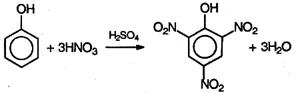
Взаимодействие с бромной водой – качественная реакция на фенол. При нитровании фенола нитрующей смесью три атома водорода замещаются на нитрогруппу, и образуется 2,4,6-тринитрофенол (пикриновая кислота):
При нагревании фенола с формальдегидом в присутствии кислотных или основных катализаторов происходит реакция поликонденсации и образуется фенолформальдегидная смола – высокомолекулярное соединение с разветвленной структурой типа:
4. Окисление. Фенолы легко окисляются даже под действием кислорода воздуха. Так, при стоянии на воздухе фенол постепенно окрашивается в розовато-красный цвет. При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона также образуется хинон:
Для идентификации фенола часто используют его реакцию с раствором FeCl3; при этом образуется комплексный ион фиолетового цвета – качественная реакция на обнаружение фенола. Применение Фенол используют как полупродукт при получении фенолформальдегидных смол, синтетических волокон, красителей, лекарственных средств и многих других ценных веществ. Пикриновую кислоту применяют в промышленности в качестве взрывчатого вещества. Крезолы используют как вещества с сильным дезинфицирующим действием.
|
||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 2661; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.58.245.158 (0.012 с.) |

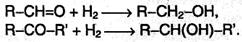
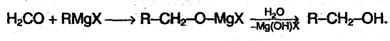
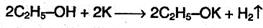
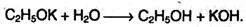

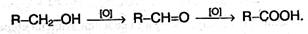
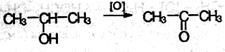
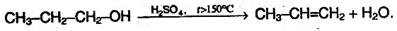


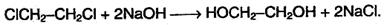
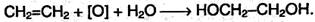


 Названияфенолов составляют с учетом того, что для родоначальной структуры по правилам ИЮПАК сохранено тривиальное название «фенол». Нумерацию атомов углерода бензольного кольца начинают от атома, непосредственно связанного с гидроксильной группой (если она является старшей функцией), и продолжают в такой последовательности, чтобы имеющиеся заместители получили наименьшие номера.
Названияфенолов составляют с учетом того, что для родоначальной структуры по правилам ИЮПАК сохранено тривиальное название «фенол». Нумерацию атомов углерода бензольного кольца начинают от атома, непосредственно связанного с гидроксильной группой (если она является старшей функцией), и продолжают в такой последовательности, чтобы имеющиеся заместители получили наименьшие номера.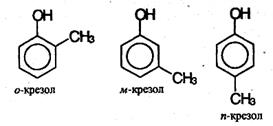



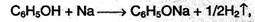

 Фенол – очень слабая кислота. При пропускании через раствор фенолятов углекислого или сернистого газов выделяется фенол; такая реакция доказывает, что фенол – более слабая кислота, чем угольная и сернистая:
Фенол – очень слабая кислота. При пропускании через раствор фенолятов углекислого или сернистого газов выделяется фенол; такая реакция доказывает, что фенол – более слабая кислота, чем угольная и сернистая: