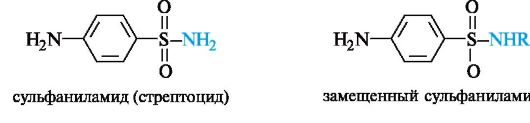Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гидроксикарбонильные соединенияСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Гидроксикарбонильными называют соединения, содержащие в молекуле одновременно гидроксильную и альдегидную (или кетон- ную) группы. В соответствии с этим различают гидроксиальдегиды и гидроксикетоны. Наиболее известными представителями этих классов соединений являются глицериновый альдегид и дигидроксиацетон, играющие в виде фосфатов большую роль в биохимических процессах. Глицериновый альдегид (глицеральдегид). Использование глицеринового альдегида в качестве конфигурационного стандарта рассмотрено выше (см. 7.1.2). d-Глицериновый альдегид образуется наряду с дигидроксиацетонфосфатом при ферментативном расщеплении d-фруктозы (в виде 1-фосфата, см. 11.1.5) и далее фосфорилируется до d-глицеральдегид-З-фосфата с помощью АТФ.
Оба фосфата, дигидроксиацетонфосфат и d-глицеральдегид-З- фосфат, образуются, кроме того, при ферментативном расщеплении 1,6-дифосфата d-фруктозы (см. 11.1.5). Важной стадией метаболизма является взаимопревращение этих монофосфатов.
Внутримолекулярная циклизация. Для гидроксикарбонильных соединений с достаточно удаленными друг от друга функциональными группами возможна внутримолекулярная циклизация. Вследствие сближения в пространстве этих групп между ними происходит взаимодействие с образованием циклических продуктов. Особенно легко внутримолекулярная циклизация протекает тогда, когда она приводит к термодинамически устойчивым пяти- и шестичленным циклам. Например, в γ- и δ-гидроксиальдегидах и гидроксикетонах возможно внутримолекулярное взаимодействие гидроксильной и карбонильной групп. В результате этого доля циклического полуацеталя в его равновесной смеси с 5-гидрокси- пентаналем составляет 94%.
Образованием циклических полуацеталей объясняется таутомерия углеводов (см. 11.1.2). Гидрокси- и аминокислоты Гидроксикислотами называют соединения, содержащие в молекуле одновременно гидроксильную и карбоксильную группы. Аминокислоты содержат в молекуле аминогруппу и карбоксильную группу. В алифатическом ряду по взаимному расположению функциональных групп различают α-, β-, γ- и т. д. гидрокси- и аминокислоты. Буквой греческого алфавита указывают положение другой функциональной группы относительно карбоксильной, при этом отсчет ведется от ближайшего к карбоксильной группе атома углерода, т. е. от атома С-2. Отметим, что в заместительной номенклатуре для замещенных карбоновых кислот локанты α-, β-, γ- и т. д. не употребляются.
Кислотно-основные свойства. В гетерофункциональных соединениях в зависимости от природы функциональных групп и их местоположения в молекуле возможно усиление или, наоборот, ослабление некоторых свойств, характерных для монофункциональных соединений. Например, кислотность гидроксикислот выше, чем незамещенных кислот. Аминокислоты, содержащие одновременно кислотные и основные фунциональные группы, проявляют амфотерные свойства, т. е. способность взаимодействовать как с кислотами, так и с основаниями. В нейтральных водных растворах или кристаллическом состоянии аминокислоты существуют преимущественно в форме внутренних солей (диполярных ионов), как показано на примере γ-аминомасляной кислоты.
α -Гидрокси- и α -аминокислоты. У α-гидроксикислот и α-аминокислот функциональные группы близки, но внутримолекулярного взаимодействия между ними не происходит из-за неустойчивости трехчленных циклов, которые могли бы при этом образоваться. При нагревании α-гидрокси- и α-аминокислоты претерпевают межмоле- кулярную циклизацию с образованием продуктов, называемых соответственно лактидами и дикетопиперазинами (последнее - от названия шестичленного гетероцикла с двумя атомами азота - пиразина). Лактиды содержат две сложноэфирные группы, дикетопиперазины - две амидные группы.
Лактиды и дикетопиперазины, являясь сложными эфирами или амидами соответственно, в условиях кислотного или основного ката- лиза способны гидролизоваться с образованием исходных α-гидрокси- или α-аминокислот. Особое свойство α-гидроксикислот заключается в их способности разлагаться при нагревании в присутствии минеральных кислот с образованием карбонильных соединений и муравьиной кислоты.
Молочная кислота известна как продукт молочнокислого брожения лактозы, содержащейся в молоке, и других углеводов, входящих в состав овощей и плодов. В организме L-(+)-молочная кислота является одним из продуктов превращения глюкозы (гликолиза). Она накапливается в мыш- цах при интенсивной работе, вследствие чего в них возникает характерная боль. Причина накопления молочной кислоты - недостаток
кислорода, что вызывает восстановление пировиноградной кислоты с участием НАДН в молочную.
Во время отдыха запасы кислорода возобновляются, и молочная кислота окисляется снова в пировиноградную кислоту. β -Гидрокси- и β -аминокислоты. Характерное общее свойство этих гетерофункциональных кислот заключается в способности к элиминированию молекулы воды или соответственно аммиака с образованием α,β-ненасыщенных кислот.
Реакции элиминирования протекают в мягких условиях. Это объясняется высокой протонной подвижностью α-атома водорода, обусловленной электронным влиянием двух электроноакцепторных групп (Х и СООН).
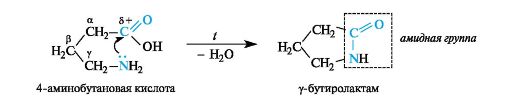
γ -Гидрокси- и γ -аминокислоты. Эти кислоты, как и кислоты с δ-расположением функциональных групп, при нагревании претерпевают внутримолекулярную циклизацию. Из гидроксикислот при этом образуются циклические сложные эфиры - лактоны, из аминокислот - циклические амиды - лактамы. Лактоны легко образуются уже при незначительном нагревании, а также в кислой среде.
Принципиально так же происходит внутримолекулярное взаимодействие амино- и карбоксильной групп в γ- и δ-аминокислотах.
Лактоны и лактамы, будучи соответственно сложными эфирами и амидами, гидролизуются в кислой или щелочной среде. 4-Гидроксимасляная кислота (традиционно называемая γ-гидроксимасляной кислотой, ГОМК) применяется в виде натриевой соли как снотворное средство, а также в анестезиологии. 4-Aминомасляная кислота (ГАМК - сокращение от γ-аминомасляной кислоты) принимает участие в обменных процессах, происходящих в головном мозге, является нейромедиатором. В медицинской практике под названием гаммалон, или аминалон, применяется в качестве ноотропного средства. Важное значение для медицины имеют производные «циклической формы ГАМК» - ее лактама (γ-бутиролактам, или пирроли- дон-2). Производное пирролидона-2 под названием пирацетам (или ноотропил) рассматривается как первый представитель ноотропных средств. Полимер N-винилпирролидона-2 - поливинилпирролидон в виде водного раствора применяется в качестве заменителя синовиальной жидкости.
Многоосновные гидроксикислоты. Рассматриваемые в этом разделе яблочная, лимонная, изолимонная кислоты, а также щавелевоуксусная (см. 9.2.4) и рассмотренные ранее янтарная и фумаровая (см. 8.1.2) кислоты являются участниками цикла трикарбоновых кислот, называемого также циклом лимонной кислоты, или циклом Кребса. Это универсальный этап окислительного катаболизма углеводов и других соединений в присутствии кислорода. Происходящие в организме превращения этих кислот являются по своей химической сути реакциями окисления или восстановления. Для каждой из этих кислот реакции катализируются специфическими ферментами с использованием коферментов. Для окислительно-восстановительных процессов наиболее характерно участие коферментов никотинамидной природы, строение и свойства которых детально рассмотрены далее (см. 14.3.2). В нижеприводимом изложении используются только их сокращенные наименования НАД+ и НАДН. Следует учитывать, что с участием НАД+ осуществляются окислительные процессы, а с участием НАДН - восстановительные.
Яблочная кислота в значительных количествах содержится в незрелых яблоках, рябине, фруктовых соках. В организме l-яблочная кислота образуется путем гидратации фумаровой кислоты.
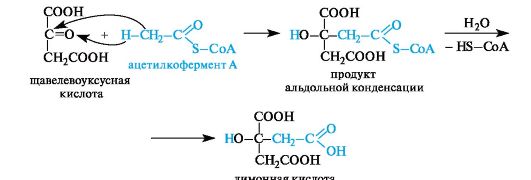
Лимонная кислота содержится в плодах цитрусовых (лимоны, апельсины), винограде, крыжовнике, а также в листьях табака. Биосинтез лимонной кислоты происходит по типу альдольной конденсации из щавелевоуксусной кислоты и ацетилкофермента А (см. 8.3.2).
При последующей дегидратации лимонной кислоты как β-гидроксикарбоновой кислоты получается цис-аконитовая кислота, которая далее гидратируется с образованием изолимонной кислоты.
Винные кислоты - представители дигидроксидикарбоновых кислот, содержат два асимметрических атома углерода и поэтому должны были бы существовать в виде четырех стереоизомеров, но в действительности известны три стереоизомера (см. 7.1.3). D -(+)-Bинная кислота, или обыкновенная винная кислота, известна под названием виннокаменной кислоты. Она содержится в ви- нограде, рябине. Кислая калиевая соль трудно растворима в воде. Она осаждается в винных бочках в виде так называемого винного камня. При нейтрализации этой соли гидроксидом натрия образуется смешанная калиево-натриевая соль. Действием на нее гидроксида меди(II) в щелочной среде получают жидкость Фелинга - реактив для обнаружения альдегидной группы (см. 11.1.5). L-(-)-Винная кислота в очень небольшом количестве содержится в виноградных винах. Мезовинная кислота (см. 7.1.3) в природе не встречается; она частично образуется при длительном нагревании в щелочном растворе любого из ее стереоизомеров. Виноградная кислота (т. пл. 205?С) представляет собой рацемат d- и l-винных кислот, оптической активностью не обладает и отличается по физическим свойствам от индивидуальных энантиомеров. Оксокислоты Оксокислотами называют соединения, содержащие в молекуле одновременно карбоксильную и альдегидную (или кетонную) группы. В соответствии с этим различают альдегидокислоты и кетонокислоты. Простейшей альдегидокислотой является глиоксалевая (глиоксиловая) кислота, которая обычно существует в виде гидрата (НО)2СНСООН. Она содержится в недозрелых фруктах, но по мере созревания ее количество уменьшается. Важную роль в биохимических процессах играют кетонокислоты - пировиноградная, ацетоуксусная и щавелевоуксусная (см. табл. 9.2). Пировиноградная кислота является одним из промежуточных продуктов молочнокислого и спиртового брожения углеводов. Своим названием пировиноградная кислота обязана тому, что впервые была выделена при пиролизе виноградной кислоты.
Пировиноградная кислота декарбоксилируется при нагревании с разбавленной и декарбонилируется (отщепляет СО) - с концент- рированной серной кислотой.
При ферментативном декарбоксилировании пировиноградной кислоты получается ацетальдегид, связанный с коферментом («активный ацетальдегид»). Он может окисляться в присутствии кофермента А в ацетилкофермент А.
Производным пировиноградной кислоты является фосфоенолпировиноградная кислота (фосфат енольной формы кислоты). В организме анион этой кислоты - фосфоенолпируват - образуется в процессе гликолиза и служит предшественником пирувата.
Щавелевоуксусная кислота одновременно является α- и β-оксокислотой. Она образуется при окислении яблочной кислоты.
Далее щавелевоуксусная кислота при конденсации с ацетилкоферментом А превращается в лимонную кислоту (см. 9.2.3). Ацетоуксусная кислота - представитель β-оксокислот. В свободном состоянии представляет сиропообразную жидкость, медленно выделяющую диоксид углерода.
Как продукт окисления 3-гидроксимасляной кислоты наряду с продуктами ее превращений накапливается в организме больных сахарным диабетом (так называемые ацетоновые, или кетоновые тела, см. Приложение 10-2).
Большое теоретическое значение в связи с вопросами таутомерии и двойственной реакционной способности имеет этиловый эфир ацетоуксусной кислоты, называемый просто ацетоуксусным эфиром. Ацетоуксусный эфир - жидкость с приятным фруктовым запахом. Впервые синтезирован более 100 лет назад, его строение долгое время было предметом острых дискуссий. Основная трудность заключалась в том, что в результате его химических превращений получались два ряда производных - ацетоуксусной и 3-гидроксикротоновой кислот, т. е. ацетоуксусный эфир проявлял двойственную реакционную способность. Исследования показали, что ацетоуксусный эфир представляет собой смесь двух изомеров - кетона (92,5%) и енола (7,5 %), находящихся в таутомерном равновесии. Это еще один пример кето-енольной таутомерии, описанной ранее на примере ацетилацетона (см. 8.4).
При действии на ацетоуксусный эфир какого-либо реагента в реакцию вступает один из таутомеров. Поскольку второй таутомер в результате равновесия восполняет убыль реагирующего таутомера, таутомерная смесь реагирует в данном направлении как одно целое.
9.3. Гетерофункциональные производные бензола как лекарственные средства Неразрывная связь химии и медицины отчетливо проявляется в области создания и использования лекарственных средств. Еще в XVI в. основатель ятрохимии Парацельс утверждал, что «настоящая цель химии заключается не в изготовлении золота, а в приготовлении лекарств». С давних времен эмпирическим путем происходил отбор биологически активных органических соединений, и появление ряда лекарственных средств часто было обязано случаю. В настоящее время все синтезируемые соединения должны проходить испытания на биологическую активность (биологический скрининг). Это важно для выявления общих закономерностей взаимосвязи структуры соединений с их биологической активностью. Проблема «струк- тура-свойство» служит фундаментом целенаправленного создания эффективных лекарственных средств.
В последние десятилетия появилось множество новых лекарственных средств. Однако большое значение сохраняют некоторые группы известных ранее лекарственных средств, в частности с бензольным ядром в качестве структурной основы. Сам бензол может быть причиной острых и хронических отравлений. Он оказывает раздражающее действие на кожу, его пары в большой концентрации вызывают возбуждение, расстройство дыхания. Монофункциональные производные бензола в большинстве случаев также обладают выраженными токсическими свойствами. Фенол, анилин, галогенопроизводные ароматического ряда служат исходными или промежуточными продуктами крупнотоннажной химической промышленности. В связи с этим необходимо учитывать их токсическое действие. Бензойная кислота. Применяется в виде натриевой соли как отхаркивающее средство. В свободном виде бензойная кислота встречается в некоторых смолах и бальзамах, а также в клюкве, бруснике, но чаще содержится в связанном виде, например в виде N-бензоильного производного аминоуксусной кислоты, называемого гиппуровой кислотой. Эта кислота образуется в печени из бензойной и аминоуксусной (глицин) кислот и выводится с мочой. В клинической практике по количеству гиппуровой кислоты в моче больных (после приема бензоата натрия) судят об эффективности обезвреживающей функции печени.
и-Аминофенол и его производные. Как гетерофункциональное соединение п -аминофенол может образовывать производные по каждой функциональной группе в отдельности и одновременно по двум функциональным группам. Сам п-аминофенол ядовит; интерес для медицины представляет его производное - парацетамол, оказывающий анальгетическое (обезболивающее) и жаропонижающее действие.
и-Аминобензойная кислота (ПАБК) и ее производные. Эфиры ароматических аминокислот способны в той или иной степени вызывать местную анестезию. Особенно заметно это свойство у пара -производных. В медицине используют анестезин (этиловый эфир ПАБК) и новокаин (2-диэтиламиноэтиловый эфир ПАБК). Новокаин при- меняют в виде соли (гидрохлорида), что связано с необходимостью повышения его растворимости в воде.
Салициловая кислота и ее производные. Салициловая кислота (см. 8.1) относится к группе фенолокислот. Как соединение с орто- расположением функциональных групп она декарбоксилируется при нагревании с образованием фенола. Салициловая кислота умеренно растворима в воде, дает интенсивное окрашивание с хлоридом железа(Ш), на чем основано качественное обнаружение фенольной гидроксильной группы. Салициловая кислота проявляет антиревматическое, жаропонижающее и антигрибковое действие, но как сильная кислота (рKа 3,0) вызывает раздражение желудочно-кишечного тракта и поэтому применяется только наружно. Внутрь применяют ее производные - соли или эфиры. Салициловая кислота способна образовывать производные по каждой функциональной группе. Практическое значение имеют салицилат натрия, сложные эфиры по карбоксильной группе - метилсалицилат, фенилсалицилат (салол), а также по гидроксильной группе - ацетилсалициловая кислота (аспирин).
Перечисленные производные (кроме салола) оказывают анальгетическое, жаропонижающее и противовоспалительное действие. Метилсалицилат из-за раздражающего действия используется наружно в составе мазей. Салол применяется как дезинфицирующее средство при кишечных заболеваниях и примечателен тем, что в кислой среде желудка не гидролизуется, а распадается только в кишечнике. В связи с этим салол используют также в качестве материала для защитных оболочек некоторых лекарственных средств, нестабильных в кислой среде желудка. Салициловая кислота впервые была получена путем окисления салицилового альдегида, содержащегося в растении таволге (род Spireae). Отсюда и ее первоначальное название - спировая кислота, с которым связано название аспирин (начальная буква «а» обозначает ацетил). Ацетилсалициловая кислота в природе не найдена. Из других производных салициловой кислоты большое значение имеет и -аминосалициловая кислота (ПАСК) как противотуберкулезное средство. ПАСК является антагонистом п -аминобензойной кислоты, необходимой для нормальной жизнедеятельности микроорганизмов.
Сульфаниловая кислота и ее производные. Сульфаниловая (п-аминобензолсульфоновая) кислота существует в виде диполярного иона.
Амид сульфаниловой кислоты (сульфаниламид), известный как стрептоцид, является родоначальником группы лекарственных средств, обладающих антибактериальной активностью и называемых сульфаниламидами.
Все сульфаниламиды содержат сульфонамидную группу -SO2NH2. Замена ее другими группами приводит к потере антибактериальной активности. Установлено, что аминогруппа в пара-положении должна оставаться незамещенной, а в бензольное кольцо нельзя вводить дополнительные заместители, так как они снижают антибактериальную активность соединения. В поиске эффективных антибактериальных средств было синтезировано более 10 тыс. производных сульфаниламида. Однако лишь несколько десятков из них нашли практическое применение. Наибольшую активность проявляют те производные, у которых радикал R имеет гетероциклическую природу.
3.2 Важнейшие гетероциклические биоорганические соединения.
|
||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-16; просмотров: 2181; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.5.176 (0.013 с.) |