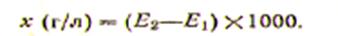Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Количественное определение глюкозыСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Глюкоза при нагревании с ортотолуидиновым реактивом дает зеленую окраску, интенсивность которой пропорциональна концентрации глюкозы. Реактивы: ортотолуидиновый реактив, стандартный раствор глюкозы 1 мг/мл, раствор глюкозы неизвестной концентрации. Оборудование: Спектрофотометр, пипетки, водяная баня, штатив, пробирки. Ход работы К 0,2 мл стандартного раствора глюкозы и 0,2 мл раствора с неизвестной концентрацией добавить по 2 мл ортотолуидинового реактива. Пробирки со смесью поместить в кипящую водяную баню на 8 минут. Пробирки вынуть, охладить под струей водопроводной воды до комнатной температуры. Оптическую плотность раствора измеряют при длине волн 590 – 650 нм. Расчет ведут по формуле:
где: Сх – концентрация глюкозы в исследуемом растворе (мг/мл); Сст – концентрация глюкозы в стандартном растворе (мг/мл); Ех – оптическая плотность исследуемого раствора; Ест – оптическая плотность стандарта. Практическое задание
Задание 1. 1. Определите число оптических изомеров для альдопентоз. 2. Изобразите проекции Фишера всех линейных изомеров альдопентоз. 3. Определите отношение изомеров к D– или L–ряду по последнему от карбонильной группы хиральному центру. 4. Найдите среди изображенных изомеров D–рибозу. Задание 2. 1. Определите число оптических изомеров у альдогексоз. 2. Изобразите проекции Фишера всех линейных изомеров альдогексоз. 3. Определите отношение углеводов к D– или L–ряду. Найдите среди изображенных изомеров D–глюкозу, D–галактозу, L–глюкозу.
ЛАБОРАТОРНАЯ работа №36 Гидролиз полисахаридов Реактивы: 1 %–й раствор сахарозы; 1,5 %–й крахмальный клейстер; фильтровальная бумага; 10 %–й раствор серной кислоты; 5 %–й раствор сульфата меди; 10 %–й раствор гидроксида натрия; концентрированная серная кислота. Оборудование: пробирки, водяная баня. Ход работы Задание 1. Гидролиз сахарозы. 1. В две пробирки поместите по 10 капель раствора сахарозы. 2. В одну пробирку добавьте 1 – 2 капли 10 %–го раствора серной кислоты. 3. Пробирку с подкисленным раствором сахарозы поставьте в почти кипящую водяную баню. Через 20 минут пробирку достаньте и охладите. 4. В обе пробирки прибавьте по 1 капле раствора сульфата меди и по каплям прибавляйте 10 %–й раствор гидроксида натрия до появления интенсивно–синей окраски, свидетельствующий о полной нейтрализации кислоты. 5. Нагрейте обе пробирки на водяной бане. В обеих ли пробирках появилась оранжево–желтая окраска? Задание 2. Гидролиз крахмала. 1. Поместите в пробирку 10 капель крахмального клейстера и добавьте 2 капли 10 %–го раствора серной кислоты. 2. Поставьте пробирку в кипящую водяную баню. Через 30 минут пробирку выньте. Раствор стал прозрачным. 3. К полученному раствору добавьте 1 каплю раствора сульфата меди и по каплям добавляйте 10 %–й раствор гидроксида натрия до появления интенсивно–синей окраски. 4. Нагрейте пробирку на водяной бане. Появляется оранжево–желтая окраска. Задание 3. Гидролиз целлюлозы. При выполнении этого задания необходимо соблюдать особую осторожность! 1. Поместите в пробирку мелкоизмельченный кусочек фильтровальной бумаги и добавьте 1–3 капли (ОСТОРОЖНО!) концентрированной серной кислоты так, чтобы кислота смочила бумагу. 2. Смесь осторожно нагрейте (обычно достаточно тепла руки) до почти полного растворения целлюлозы. 3. К полученному раствору добавьте 10 капель воды, хорошо перемешайте и поместите пробирку в кипящую водяную баню на 30 минут. 4. По окончании реакции к небольшой порции раствора прибавьте 1 каплю раствора сульфата меди и по каплям добавляйте 10 %–й раствор гидроксида натрия до появления интенсивно–синей окраски. 5. Нагрейте пробирку на водяной бане. Появляется оранжево–желтая окраска. Оформление результатов Оформите проведенные исследования в виде таблицы. Сделайте выводы о структуре полисахаридов и продуктах его гидролиза.
Лабораторная работа № 39 ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ УГЛЕВОДОВ МЕТОДОМ ТОНКОСЛОЙНОЙ ХРОМАТОГРАФИИ Цель работы: ознакомиться с методом тонкослойной хроматографии углеводов. Принцип метода. При проведении хроматографического разделения углеводов методом тонкослойной хроматографии пластинку с тонким слоем пористого носителя (например, пластинку SiluFol), на которую нанесены растворы углеводов, помещают в растворитель, который, продвигаясь за счет капиллярных сил, перемещает углевод. По завершению хроматографии проводят обработку пластинки, позволяющую выявить пятна углевода, и расчетным методом определяют массу углевода в исследуемом растворе. Оборудование и реактивы: пластинки Silufol или SilufoI–UV, исследуемый (раствор меда) и стандартный (10 мкг в пробе) раствор углевода (глюкозы, галактозы, фруктозы, сахарозы, мальтозы), растворитель — смесь бутанол-ацетон-вода (4:5:1), в случае использования пластинок Silufol нафторезорциновый реактив (свежеприготовленная смесь равных объемов 20 %-го водного раствора трихлоруксусной кислоты и 0,2 %-го спиртового раствора нафторезорцина). Микропипетки, пульверизатор в случае использования пластинок SilufoI или источник ультрафиолетового света в случае использования пластинок Silufol–UV, хроматографическая камера, линейка, простой карандаш, планиметр, сушильный шкаф. Ход работы Ha пластинке на расстоянии2 смот нижнего края (линия старта) аккуратно намечают карандашом три точки нанесения растворов углеводов. C помощью микропипетки в отмеченные места наносят равные объемы исследуемого раствора углевода (5 – 20 мкг в пробе), разбавленного исследуемого раствора углевода и стандартного раствора углевода таким образом, чтобы получить пятна одного диаметра. После высушивания пятен пластинку помещают в хроматографическую камеру, на дне которой находится растворитель — смесь бутанол-ацетон- вода (4:5:1). Высота слоя растворителя —1 см. Хроматографию проводят до прохождения растворителем10 смот линии старта. После этого хроматограмму высушивают и проявляют. При использовании пластинок Silufol хроматограмму опрыскивают из пульверизатора раствором нафторезорцина и сушат в сушильном шкафу 5 – 10 мин при температуре 90 – 100 ºС для проявления пятен углевода. Пятна глюкозы и галактозы имеют сине–фиолетовый цвет, фруктозы — красно–черный, сахарозы и мальтозы — красный, лактозы — красно–фиолетовый, рамнозы — зеленый, ксилозы — светло–серый, манозы — светло–синий, арабинозы — сине–зеленый. B случае использования пластинок Silufol–UV пятна углевода выявляют под ультрафиолетовым светом. Определяют площадь пятен. Массу углевода в пробе исследуемого раствора (мкг) рассчитывают по формуле
где Мst – масса углевода в пробе стандартного раствора; Sst, S, Sp – площади пятна стандарта; исследуемого раствора и разбавленного исследуемого раствора; P – фактор разведения. Оформление работы Привести расчеты по приготовлению реактивов. Провести ТСХ углеводов, идентифицировать их и определить содержание в пробе.
ЛАБЫ НА ЛИПИДЫ Определение содержания β -липопротеинов плазмы крови. Теоретическое введение. Большинство липидов находится в крови не в свободном состоянии, а в составе белково-липидных комплексов: хиломикроны, α-липопротеиды и β -липопротеиды. Липопротеиды можно разделить различными методами: электрофореза, тонкослойной хроматографии, ультрацентрифугирования в солевых растворах различной плотности. При ультрацентрифугировании выделяются хиломикроны и липопротеиды разной плотности: высокой (ЛВП—α-липопротеиды), низкой (ЛНП—β -липопротеиды) и очень низкой (ЛОНП—пре- β -липопротеиды) и др. Фракции липопротеидов отличаются по количеству белка, относительной молекулярной массе липопротеидов и процентному содержанию отдельных липидных компонентов. Так, α-липопротеиды, содержащие большое количество белка (50—60%), имеют и более высокую относительную плотность (1,063—1,21), тогда как β -липопротеиды и пре-β -липопротеиды содержат меньше белка и значительное количество липидов — до 95% от всей относительной молекулярной массы и низкую относительную плотность (1,01 —1,063). Принцип метода. В основу метода положена способность β -липопротеидов (ЛПНП) осаждаться в присутствии хлорида кальция и гепарина; при этом изменяется мутность раствора. По степени помутнения раствора и судят о концентрации β -липопротеидов в сыворотке крови. Считают, что гепарин способен образовывать с β -липопротеидами комплекс, который под действием хлорида кальция выпадает в осадок. Реактивы, оборудование и исследуемый материал: 1. Хлорид кальция (СаСI2) 0,27% раствор (готовят из безводного реактива). 2. Гепарин, 1% раствор (готовят ex tempore), 1 мл его должен содержать 1000 ЕД (лучше кристаллический). 3. ФЭК. 4. Микропипетка вместимостью 0,2 мл. 5. Сыворотка крови. Ход работы. В пробирку вносят 2 мл 0,27% раствора СаС12 и 0,2 мл сыворотки крови, перемешивают. Определяют оптическую плотность раствора (Е1) против 0,27% раствора СаС12 по левому барабану в кюветах на 5 мм, при красном светофильтре (630 нм). Раствор из кюветы переливают в пробирку, добавляют микропипеткой 0,04 мл 1 % раствора гепарина, перемешивают и точно через 4 мин снова определяют оптическую плотность раствора (Е2) в тех же условиях:
Расчет. Вычисляют разность оптической плотности и умножают ее на 1000 — эмпирический коэффициент, так как построение калибровочной кривой сопряжено с рядом трудностей. Ответ выражают в г/л. В норме содержание β -липопротеидов составляет 3—4,5 г/л (300—450 мг %). Содержание β -липопротеидов колеблется в зависимости от возраста и пола. 1. Экстракция липидов из биологического материала. Теоретическое введение. При экстракции липидов принимают во внимание то, что они способны не только к гидрофобным, взаимодействиям, но и к образованию водородных, электростатических и ковалентных связей (сложноэфирных, амидных, гликозидных). Относительно неполярные растворители (хлороформ, бензол, диэтиловый эфир) разрушают комплексы, образованные гидрофобными взаимодействиями в жировой ткани, комплексы альбумина с жирными кислотами. Полярные растворители (этанол, метанол) разрушают водородные и электростатические связи. Их применяют в смеси со слабополярными растворителями при экстракции липидов из плазматических мембран, митохондрий, эндоплазматического ретикулума. Липиды, находящиеся в комплексах, образованных ковалентными связями, растворителями не экстрагируются. Их можно выделить только после гидролиза комплекса слабыми растворами кислот или щелочей в органическом растворителе. Наиболее распространенным методом экстракции липидов является метод Фолча. Экстракцию проводят смесью хлороформ—метанол (2:1) из расчета 20 частей, экстрагирующей смеси на одну часть ткани. Метод позволяет выделить 90—95% всех клеточных липидов. Смеси растворителей, содержащие спирт, экстрагируют также нелипидные вещества (сахара, аминокислоты, соли и т. д.). Для удаления нелипидных примесей, экстракт липидов промывают водой или слабыми солевыми растворами. Однако это приводит к частичной потере кислых липидов. Очистку экстракта можно провести также гельфильтрацией на сефадексе. Липиды легко подвергаются окислению и гидролитической деградации. Чтобы затормозить эти процессы, экстракцию липидов проводят при комнатной температуре, применяя растворители, из которых предварительно удален кислород. Извлеченные липиды не упаривают досуха и не оставляют в упаренном виде на долгое время, а сразу растворяют. Экстракты липидов следует хранить в плотно закрытой посуде при -20°С и ниже в присутствии инертных газов. Можно применять антиоксиданты, например 2,6-ди-трет-бутил-n-крезол, который в концентрации 0,005% эффективно предотвращает окислительное расщепление ненасыщенных липидов. Внимание! Все органические растворители: хлороформ, метанол, гексан, диэтиловый эфир — в той или иной степени ядовиты, поэтому работать с ними нужно под тягой и ни в коем случае не насасывать в пипетку ртом. Диэтиловый эфир легко воспламеняется, а пары его в воздухе образуют опасные горючие смеси (летуч, кипит при 36°С), поэтому при работе с ним необходимо соблюдать осторожность! При работе с липидами необходимо пользоваться стеклянной посудой с пришлифованными стеклянными пробками. Смазкой для шлифов пользоваться нельзя! Можно прикрывать колбы и пробирки алюминиевой фольгой. 2. Фракционирование липидов методом адсорбционной хроматографии. Теоретическое введение. Наиболее эффективным и широко применяемым методом фракционирования сложных смесей липидов является хроматография. Главную роль при аналитическом фракционировании играет адсорбционная хроматография в тонком слое сорбента. Этот метод также применяется в препаративных целях, когда разделению подвергается небольшое количество липидов (50—300 мг). Если масса липидов превышает 300 мг, используют колоночную хроматографию, хотя по разделяющей способности и времени разделения этот метод часто уступает тонкослойной и газовой хроматографии. Однократного хроматографирования обычно бывает недостаточно для выделения индивидуальных веществ, в связи с этим полученные фракции подвергают препаративной тонкослойной хроматографии или колоночной хроматографии другого типа. При колоночной хроматографии липидов используют не только принцип адсорбции, но и принцип распределения между двумя несмешивающимися жидкостями, гель-фильтрации, ионного обмена. В основе адсорбционной хроматографии лежит разделение липидов в соответствии со степенью их полярности. Адсорбентом при тонкослойной хроматографии чаще всего служит силикагель. При колоночной хроматографии широкое применение получили три адсорбента: силикагель, окись алюминия, флоризил (силикат магния). Прочность взаимодействия липида с адсорбентом определяется главным образом водородными и ионными связями, в меньшей степени — силами Ван-дер-Ваальса. Хроматография на силикагеле. Силикагель является продуктом полимеризации ортокремниевой кислоты (H4SiО4). Он выпускается рядом фирм в виде зерен различной величины. Адсорбционные свойства силикагеля обусловлены присутствием на поверхности зерен гидроксильных групп, которые за счет водородных связей взаимодействуют друг с другом и водой. Гидратированный силикагель мало активен как адсорбент. При нагревании от 50 до 150°С происходит дегидратация, приводящая к значительному увеличению адсорбционной способности силикагеля. При хроматографии 1—3 г липидов пользуются колонками диаметром 35 мм и длиной 50—70 см. При разделении больших количеств применяют большие колонки, при этом максимальное весовое отношение липид/адсорбент не должно превышать 1:50 (для фосфолипидов 1:100). Отношение высоты колонки к площади ее сечения должно быть равно 5:1, длина колонки не должна быть больше 1 м. При аналитической хроматографии толщина слоя силикагеля обычно не превышает 0,25 мм. Для препаративных целей используют слои толщиной 0,75—1,0 мм на пластинках размером 20Х20 см. В некоторых случаях для лучшего разделения используют удлиненные пластинки (34X20 см). Для аналитического разделения липидов можно применять готовые пластинки. Они представляют собой тонкий слой силикагеля, закрепленный на алюминиевой фольге с помощью крахмала. Для подготовки пластинок к работе их необходимо активировать. Хроматография на окиси алюминия. При проведении препаративных работ хроматография на окиси алюминия имеет ряд преимуществ по сравнению с хроматографией на силикагеле: требуются меньшие объемы растворителей, скорость тока через колонку выше. Для хроматографии фосфолипидов используют окись алюминия IV степени активности. Ее получают путем активации коммерческой окиси алюминия при 110°С в течение 12 ч, после чего на каждые 100 г адсорбента добавляют 10 мл воды и встряхивают смесь в закрытом сосуде в течение Однако необходимо отметить, что хроматография многих липидных веществ на окиси алюминия сопровождается значительными потерями в результате гидролиза. Омыляемые липиды Лабораторная работа № 31
|
||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-16; просмотров: 745; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.107.223 (0.011 с.) |

 ,
,